题目内容
【题目】一定条件下,在三个容积均为2L的恒容密闭容器中发生反应:H2(g)+CO2(g) ![]() HCOOH(g)。下列说法正确的是
HCOOH(g)。下列说法正确的是
容器编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/mol | |
H2 | CO2 | HCOOH | |||
Ⅰ | 150 | 0.4 | 0.4 | 0.2 | 2 |
Ⅱ | 150 | 0.8 | 0.8 | t1 | |
Ⅲ | 0.4 | 0.4 | 0.16 | t2 | |
A. 反应达到平衡时,容器Ⅰ中的平均反应速率为v(H2)=0.1mol/(L·min)
B. 反应达到平衡时,容器Ⅱ所需时间t2<2min
C. 若只改变一个反应条件,容器Ⅲ可能是加入了合适的催化剂
D. 起始时,向容器Ⅱ中充入0.45mol H2、0.20mol CO2 和0.18molHCOOH,则反应向正反应方向进行
【答案】BD
【解析】A. 反应达到平衡时,容器Ⅰ中的平均反应速率为v(H2)=v(HCOOH)= △n/V△t= 0.05mol/(L·min),错误;B. 容器Ⅱ中反应物的浓度比容器Ⅰ反应物的浓度大,反应速率快,达平衡的时间短,故 反应达到平衡时,容器Ⅱ所需时间t2<2min,正确;C. 若只改变一个反应条件,容器Ⅲ和容器Ⅰ相比,平衡逆向移动,而使用催化剂平衡不移动,错误;D. 利用Q和K的关系判断,起始时,向容器Ⅱ中充入0.45mol H2、0.20mol CO2 和0.18molHCOOH,Q<K,则反应向正反应方向进行,正确。

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
【题目】用下图所示装置进行下列实验,实验结果与预测的现象不一致的是
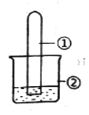
选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
A | NO2 | 蒸馏水 | 试管充满无色溶液 |
B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
C | NH3 | AlCl3溶液 | 产生白色沉淀 |
D | Cl2 | AgNO3溶液 | 产生白色沉淀 |
A. A B. B C. C D. D

