题目内容
(一)根据要求回答下列问题:
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He
(1)含有共价键的离子化合物是(用序号回答) ,含有共价键的共价化合物是(用序号回答) .
(2)当其熔化时,不破坏化学键的是(用序号回答) .
(二)写出下列物质或微粒的电子式:H2O ;Na2O ;CO2 .
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He
(1)含有共价键的离子化合物是(用序号回答)
(2)当其熔化时,不破坏化学键的是(用序号回答)
(二)写出下列物质或微粒的电子式:H2O
考点:离子化合物的结构特征与性质,电子式,共价键的形成及共价键的主要类型
专题:化学用语专题,化学键与晶体结构
分析:(一)(1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;
(2)熔化时不破坏化学键,说明该物质中只存在共价键,为分子晶体;
(二)首先判断化合物是离子化合物还是共价化合物;依据电子式的书写写出,即把原子的最外层电子表示出来;
若是离子化合物,其电子式由阴、阳离子的电子式组合而成,相同的离子不能合并;
若是共价化合物,其电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况.
(2)熔化时不破坏化学键,说明该物质中只存在共价键,为分子晶体;
(二)首先判断化合物是离子化合物还是共价化合物;依据电子式的书写写出,即把原子的最外层电子表示出来;
若是离子化合物,其电子式由阴、阳离子的电子式组合而成,相同的离子不能合并;
若是共价化合物,其电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况.
解答:
解:(一)(1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,所以含有共价键的离子化合物有③⑤⑥,含有共价键的共价化合物是②④⑦,
故答案为:③⑤⑥; ②④⑦;
(2)熔化时不破坏化学键,说明该物质中只存在共价键,为分子晶体,属于分子晶体的有②④⑦⑧⑨,所以熔化时不需要破坏化学键的是②④⑦⑧⑨,故答案为:②④⑦⑧⑨;
(二)H2O是共价化合物,是由原子和氢原子形成共价键,电子式为 ;
;
Na2O是钠离子和氧根离子构成的离子化合物,钠离子失电子形成阳离子,氧原子得到电子形成阴离子,电子式为 ,
,
CO2是共价化合物,碳原子有四个电子分别和氧原子形成两对共用电子对,电子式为 ,
,
故答案为: ;
; ;
; .
.
故答案为:③⑤⑥; ②④⑦;
(2)熔化时不破坏化学键,说明该物质中只存在共价键,为分子晶体,属于分子晶体的有②④⑦⑧⑨,所以熔化时不需要破坏化学键的是②④⑦⑧⑨,故答案为:②④⑦⑧⑨;
(二)H2O是共价化合物,是由原子和氢原子形成共价键,电子式为
 ;
;Na2O是钠离子和氧根离子构成的离子化合物,钠离子失电子形成阳离子,氧原子得到电子形成阴离子,电子式为
 ,
,CO2是共价化合物,碳原子有四个电子分别和氧原子形成两对共用电子对,电子式为
 ,
,故答案为:
 ;
; ;
; .
.
点评:本题考查了化学用语,涉及电子式的书写、化学键的判断,明确物质的构成微粒及微粒间的作用力是解本题关键,注意离子化合物、共价化合物电子式的书写区别,为易错点.

练习册系列答案
相关题目
选择恰当的试剂和方法除去下列物质中的少量杂质(括号内为杂质)
(1)C2H6(C2H4)试剂 ,方法 .
(2)溴苯(溴)试剂 ,方法 .
(3)苯(甲苯)试剂 ,方法 .
(4)溴化钠(溴)试剂 ,方法 .
(1)C2H6(C2H4)试剂
(2)溴苯(溴)试剂
(3)苯(甲苯)试剂
(4)溴化钠(溴)试剂
下列说法正确的是( )
| A、常温常压下,8克O3含有0.5NA个氧原子(相对原子质量O:16) |
| B、1mol?L-1的Ca(ClO)2溶液中含ClO-数目为2NA |
| C、标准状况下,22.4L HCl溶于1L水中所得的盐酸含有NA个HCl分子 |
| D、1mol Na被完全氧化生成Na2O2,失去2NA个电子 |
已知C-C单键可以绕键轴旋转,其结构简式可表示为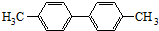 的烃,下列说法中不正确的是( )
的烃,下列说法中不正确的是( )
 的烃,下列说法中不正确的是( )
的烃,下列说法中不正确的是( )| A、该烃是苯的同系物 |
| B、该烃的一氯代物最多有3种 |
| C、分子中至少有8个碳原子处于同一平面上 |
| D、2mol该化合物完全燃烧消耗35mol O2 |
 ③白磷 ④18O ⑤
③白磷 ④18O ⑤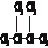 ⑥红磷 ⑦16O ⑧氯气.
⑥红磷 ⑦16O ⑧氯气.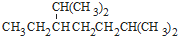 的名称为
的名称为 名称
名称 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题: