题目内容
下列对浓H2SO4的叙述正确的是( )
A.常温下,浓H2SO4与铁、铝不反应,所以铁质、铝质容器能盛放浓H2SO4
B.浓H2SO4具有吸水性,能使蔗糖炭化
C.浓H2SO4和铜片共热,H2SO4既能表现出酸性,又能表现出强氧化性
D.浓H2SO4与亚硫酸钠反应制取SO2时,浓H2SO4表现出强氧化性
C
解析:
A.常温下浓H2SO4与铁、铝接触,能使金属表面生成一层致密的氧化物保护膜,阻止内部金属继续跟硫酸反应。这就是金属的钝化现象。金属钝化现象是浓H2SO4与这些金属发生反应引起的,所以说常温下浓H2SO4与铁、铝不反应的说法是错误的。
B.浓硫酸从蔗糖中夺取与水分子组成相当的氢和氧,使蔗糖炭化,体现了浓硫酸的脱水性而不是吸水性。
C.铜与浓H2SO4在加热条件下发生反应,其方程式为:
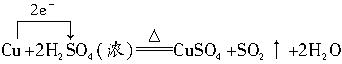
反应中浓H2SO4为氧化剂,铜为还原剂,氧化剂与还原剂物质的量之比为1∶1。因每反应的2 mol浓H2SO4中,1 mol作氧化剂,还有1 mol起酸的作用(生成盐和水)。
D.实验室中是用浓H2SO4与固体亚硫酸钠反应来制取二氧化硫的。其反应方程式为:Na2S+4O3+H2S+6O4(浓) ====Na2S+6O4+S+4O2↑+H2O
在反应物中硫元素处于邻位价态,根据氧化还原反应规律,知它们之间是不可能发生氧化还原反应的,应为复分解反应,其原理是用难挥发性酸制易挥发性酸,强酸制弱酸,因而在此反应中浓H2SO4体现的是难挥发性和酸性。

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
下列对浓H2SO4的叙述正确的是( )
| A、常温下,浓H2SO4与铁、铝不反应,所以铁、铝质容器能盛装浓H2SO4 | B、浓H2SO4具有吸水性,能使蔗糖炭化 | C、浓H2SO4和铜片加热既表现强酸性,又表现强氧化性 | D、浓H2SO4和Na2SO3反应制取SO2时,浓H2SO4表现出强氧化性 |