题目内容
某研究性学习小组探究铁粉与水蒸气反应后的固体的组成,铁粉与水蒸气反应的化学方程式为 。
基于上述反应所得黑色固体粉末,研究性学习小组提出下列假设并欲做实验分析。
假设一:固体全部是Fe3O4
假设二:固体全部是Fe
假设三:固体是
取铁粉与水蒸气反应后的固体作为样品,进行如下实验探究。
探究1:取少量样品投入硫酸铜稀溶液中,若现象为 ,则假设一成立。
探究2:取1.68g样品在纯氧中灼烧后,若质量为 g,则假设二成立。
经过实验探究,假设一、二都不成立。
探究3:取样品4.00g进行如下实验。
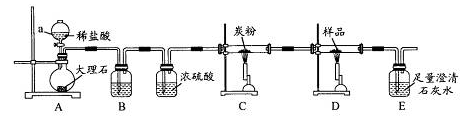
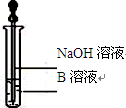
B中的溶液是 ;实验后经测定样品完全反应,D中剩余固体质量为3.36g,且测得E中沉淀质量为6.0g,则样品中Fe3O4的质量分数为 ;实验装置中有一明显缺陷是 。
基于上述反应所得黑色固体粉末,研究性学习小组提出下列假设并欲做实验分析。
假设一:固体全部是Fe3O4
假设二:固体全部是Fe
假设三:固体是
取铁粉与水蒸气反应后的固体作为样品,进行如下实验探究。
探究1:取少量样品投入硫酸铜稀溶液中,若现象为 ,则假设一成立。
探究2:取1.68g样品在纯氧中灼烧后,若质量为 g,则假设二成立。
经过实验探究,假设一、二都不成立。
探究3:取样品4.00g进行如下实验。

B中的溶液是 ;实验后经测定样品完全反应,D中剩余固体质量为3.36g,且测得E中沉淀质量为6.0g,则样品中Fe3O4的质量分数为 ;实验装置中有一明显缺陷是 。
3Fe+4H2O(g)
 Fe3O4+4H2(2分)
Fe3O4+4H2(2分)假设三:Fe3O4和Fe的混合物(1分)
探究1:若溶液无颜色变化(1分)
探究2:2.32(2分)
探究3:饱和碳酸氢钠溶液(1分) 58%(2分) 没有处理尾气装置,尾气中的CO将污染空气(1分)
试题分析:
本题是一道探究性的实验题。铁粉与水蒸气反应的化学方程式为3Fe+4H2O(g)
 Fe3O4+4H2
Fe3O4+4H2上述反应如果铁粉全反应完,那么固体就是Fe3O4,如果铁粉一点都没反应,那就是Fe,当然还有铁粉部分反应,还剩余一部分。得到的是Fe3O4和Fe的混合物。为了验证三种假设,做了以下实验。取少量样品投入硫酸铜稀溶液中,若为Fe3O4,则没有Fe粉剩余,所以CuSO4不反应。若取1.68g样品在纯氧中灼烧后,样品全是铁粉,可以算出n(Fe)=0.03mol,则求出n(Fe3O4)=0.01mol,m(Fe3O4)= 2.32g。
若样品是二者混合物(Fe3O4和Fe):
实验从左到右发生装置→除杂装置→干燥装置→性质检验装置
CO2与C反应得到CO,还原Fe3O4得到Fe和CO2,在通过足量Ca(OH)2溶液检验和测定沉淀质量来确CO2的量。A装置中产生CO2会带出HCl,HCl会与D中样品发生反应,所以B装置用来除去HCl气体用饱和NaHCO3溶液。浓硫酸在干燥后得到纯净的CO2气体,与碳粉反应得到CO,在还原D中Fe3O4。所以D中减少的质量就是m(O)=0.64g n(O)=0.04mol n(Fe3O4)=0.01mol m(Fe3O4)=2.32g
ω(Fe3O4)=
 =
=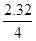 ×100%=58%,同时可以计算这个过程中生成n(CO2)=0.06mol。而根据m(CaCO3)可以计算n(CO2)=0.06mol,说明经过碳粉后还剩余0.02mol CO2。由于碳粉与CO2高温反应产生CO,CO高温还原Fe3O4后可能还有CO剩余,所以缺一尾气处理装置。因为CO不能直接排入大气。
×100%=58%,同时可以计算这个过程中生成n(CO2)=0.06mol。而根据m(CaCO3)可以计算n(CO2)=0.06mol,说明经过碳粉后还剩余0.02mol CO2。由于碳粉与CO2高温反应产生CO,CO高温还原Fe3O4后可能还有CO剩余,所以缺一尾气处理装置。因为CO不能直接排入大气。
练习册系列答案
相关题目
 Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验: