题目内容
五颜六色的变化增添了化学的魅力。下列有关反应的颜色变化叙述:①新制氯水久置后→无色;②淀粉溶液遇单质碘→蓝色;③溴化银见光分解→银白色;④热的氧化铜遇乙醇→红色;⑤硝酸银溶液和碘化钾溶液产生沉淀→黄色;⑥苯酚在空气中被氧化→粉红色。其中正确的是
| A.①②④⑤⑥ | B.②③④⑤⑥ | C.①②③④⑤ | D.①④⑤⑥ |
A
解析试题分析:①氯水久置后,HClO分解生成HCl和O2,黄绿色褪去,正确;②碘单质与淀粉显示蓝色,正确;③碘化银分解生成银颗粒,为黑色,错误;④乙醇具有还原性,将氧化铜还原为铜变成红色;⑤碘化银为黄色沉淀;⑥苯酚易被空气氧化为醌类物质,为粉红色。
考点:元素及化合物性质

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验过程中的现象及结论均正确且存在因果关系的是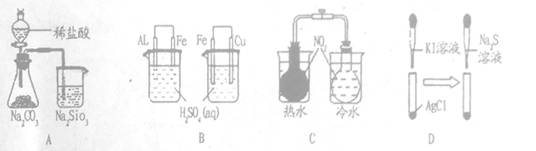
| 实验 | 实验现象 | 结论 |
| A | 锥形瓶中有气体产生,烧杯中液体变混浊 | 非金属性:Cl>S>Si |
| B | 左烧杯铝表面冒气泡,右烧杯铜表面冒气泡 | 活动性:Al>Fe>Cu |
| C | 左烧杯气体颜色加深,右烧杯气体颜色变浅 | NO2转化为N2O4吸热 |
| D | 白色固体先变为黄色,后变为黑色 | 溶解度:AgCl>AgI>Ag2S |
HArF是第一个被发现的氩化合物,其分子的比例模型如图所示,在HArF中氟为-l价,氩为0价,其水溶液显强酸性,酸性与盐酸相当。下列有关说法错误的是( )
| A.稀有气体在一定条件下也可发生化学反应 |
| B.HAlF为极性分子 |
| C.ArF-具有较强的氧化性 |
| D.向HArF溶液中加入NaOH,反应的离子方程式为:H++OH-=H2O |
下表所列各组物质中,物质之间不能实现如下图箭头所示方向转化的是
| | 甲 | 乙 | 丙 |
| A | NO | NO2 | HNO3 |
| B | AlCl3 | Al(OH)3 | NaAlO2 |
| C | S | H2S | SO2 |
| D | Si | SiO2 | H2SiO3 |
用图中所示的装置进行实验,实验现象与预测不一致的是
| | ①中的物质 | ②中的物质 | 预测现象 |
| A | 浓氨水 | FeCl3溶液 | ②中有红褐色沉淀 |
| B | 浓氨水 | 浓盐酸 | ③中有白烟 |
| C | 浓硝酸 | 淀粉KI溶液 | ②中溶液变为蓝色 |
| D | 饱和亚硫酸 | 蓝色石蕊试液 | ②中溶液先变红色又褪色 |
下述实验能达到预期目的的是
| 编号 | 实验内容 | 实验目的 |
| A | 取两只试管,分别加入4 mL 0.01 mol/L KMnO4酸性溶液,然后向一只试管中加入0.1 mol/L H2C2O4溶液 2 mL,向另一只试管中加入0.1 mol/L H2C2O4溶液 4 mL,记录褪色时间 | 证明草酸浓度越大反应速率越快 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向1mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下,溶解度Mg(OH)2 >Fe(OH)3 |
| D | 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
下列实验现象可用同一原理解释的是
| A.品红溶液中分别通入SO2和Cl2,品红均褪色 |
| B.溴水分别滴入植物油和裂化汽油中,溴水均褪色 |
| C.鸡蛋白溶液中分别加入NaCl溶液和HgCl2溶液,均有固体析出 |
| D.分别加热盛有NH4Cl和单质碘的试管,管口均有固体凝结 |
下列有关物质的性质与应用不相对应的是
| A.CaH2能与水反应生成H2,可用作野外制氢气 |
| B.NH3具有还原性,可与灼热的CuO反应制备少量氮气 |
| C.SO2具有还原性,可使酸性高锰酸钾溶液褪色 |
| D.Si能导电,可用于制作光导纤维 |