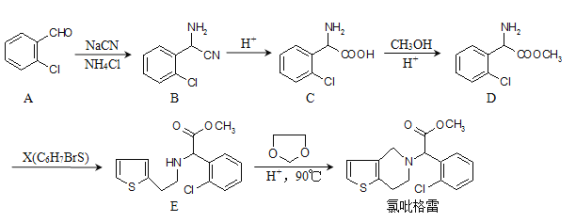
题目内容
【题目】能源是人类生存和发展的重要支柱,化学在能源的开发与利用方面起着十分重要的作用。某学习小组按如下图所示装置探究化学能与电能的相互转化:
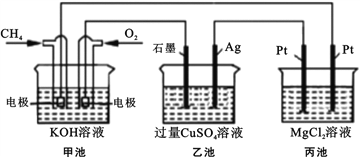
(1) 甲池是_____装置,通入CH4气体的电极上的反应式为_____。乙池中SO42- 移向_____电极(填“石墨”或“Ag”)
(2) 当甲池消耗标况下33.6LO2时,电解质KOH的物质的量变化_____mol,乙池若要恢复电解前的状态则需要加入_____g _____(填物质名称)。
(3) 丙池中发生的电解反应的离子方程式为_____。
【答案】 原电池(或化学能转化为电能) CH4 –8e-+ 10OH- ═ CO32-+ 7H2O 石墨 1.5 240 氧化铜 (或372,碳酸铜) Mg2+ +2Cl-+2H2O ![]() Mg(OH)2↓+ H2↑+ Cl2↑
Mg(OH)2↓+ H2↑+ Cl2↑
【解析】(1)由图可看出甲图为燃料电池装置,是原电池,通入甲烷的电极为负极,反应式为CH4 –8e-+ 10OH-=CO32-+ 7H2O,通入氧气的电极为正极,乙图和丙图为电解池,与电池的正极相连的石墨为阳极,与电池的负极相连的Ag电极为阴极,乙池中SO42- 移向石墨极(阳极)。(2)原电池正极反应式为:2O2+8e-+4H2O=8OH-,总反应为:CH4 +2O2+ 2OH-=CO32-+ 3H2O,当甲池消耗标况下33.6L(1.5mol)O2时,消耗1.5molKOH,转移6mol电子,则乙池生成3molCu和1.5molO2,根据原子守恒,若要恢复电解前的状态则需要加入氧化铜:3mol×80g/mol=240g,或碳酸铜:3mol×124g/mol=372g。(3)丙池中惰性电极电解氯化镁溶液,电解反应的离子方程式为Mg2+ +2Cl-+2H2O ![]() Mg(OH)2↓+ H2↑+ Cl2↑。
Mg(OH)2↓+ H2↑+ Cl2↑。