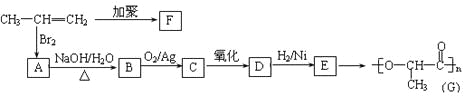
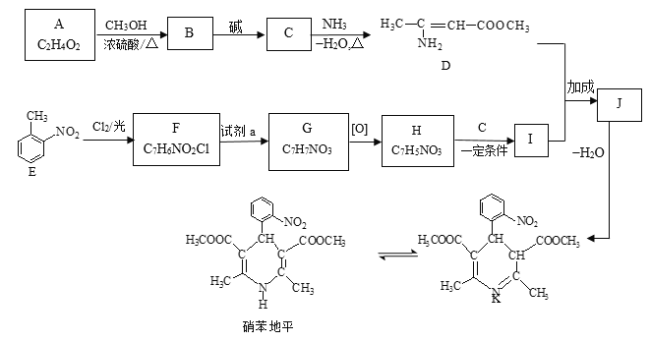
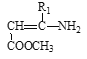题目内容
【题目】缓解当前能源和资源紧张问题的方法无非是开源和节流两个方面,从开源角度看,有效地开发利用燃煤产生的CO2重新合成新的燃料是一个途径,目前工业上用CO2来生产甲醇的原理是CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
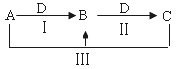
(1)上述反应过程中的能量变化如图所示,该反应是_____________(填“吸热”或“放热”)反应。
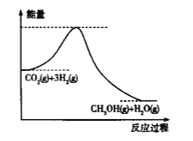
(2)一定温度下,将5molCO2和8molH2充入2L恒容密闭容器中发生上述反应,测得H2的物质的量与时间的关系如图所示,
0-1min内,用CO2表示的平均反应速率v(CO2)=________________(保留两位有效数字);a点的逆反应速率________________b点的逆反应速率(填“>”“<”或“=”)。
(3)对于在恒温恒容条件下进行的反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下列叙述不能说明其已达到平衡状态的是________________(填序号)。
CH3OH(g)+H2O(g),下列叙述不能说明其已达到平衡状态的是________________(填序号)。
a. 混合气体的密度不再改变
b. 容器内的压强不再发生变化
c. CH3OH(g)的浓度保持不变
d. 单位时间内消耗1molCO2,同时生成1molCH3OH
(4)甲醇燃料电池是一种高效、环境友好的发电装置,结构如图所示(电解质溶液为稀硫酸):

①Pt(b)电极上发生_____________(填“氧化”或“还原”)反应,电极反应式为________________________。
②如果该电池工作时导线中通过3mol电子,则理论上消耗甲醇的物质的量为__________________。
【答案】放热 0.33mol/(L·min) < ad 还原 O2+4e-+4H+=2H2O 0.5mol
【解析】
(1)根据吸热反应、放热反应中反应物和生成物的能量大小关系分析;
(2)根据速率的计算公式进行计算;根据可逆反应平衡建立过程中正逆反应速率的变化分析;
(3)由化学平衡状态的判断方法分析;
(4)由燃料电池的工作原理分析解答。
(1)由能量变化图可知,该反应中反应物的总能量高于生成物的总能量,故该反应为放热反应;
(2)由图像可知,0-1min内,![]() ,则
,则![]() ,则用CO2表示的平均反应速率
,则用CO2表示的平均反应速率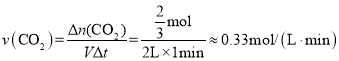 ;由于该反应是从正反应方向建立平衡的,则在平衡之前,正反应反速率逐渐减小,逆反应速率逐渐增大,故a点的逆反应速率<b点的逆反应速率;
;由于该反应是从正反应方向建立平衡的,则在平衡之前,正反应反速率逐渐减小,逆反应速率逐渐增大,故a点的逆反应速率<b点的逆反应速率;
(3)反应条件为恒温、恒容,该反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的正反应方向是气体分子数减少的反应,
CH3OH(g)+H2O(g)的正反应方向是气体分子数减少的反应,
a. 由质量守恒定律可知,混合气体的质量始终保持不变,又容器的容积不变,则混合气体的密度始终保持改变,则混合气体的密度不再改变时,不能说明反应已达到平衡状态,故a符合;
b. 该反应的正反应方向是气体分子数减少的反应,则随着反应的进行,容器内压强会发生变化,故容器内的压强不再发生变化时,能说明反应已达到平衡状态,故b不符合;
c. CH3OH(g)的浓度保持不变,说明正逆反应速率相等,能说明反应已达到平衡状态,故c不符合;
d. 单位时间内消耗1molCO2,同时生成1molCH3OH,均表示正反应速率,不能说明正逆反应速率相等,故单位时间内消耗1molCO2,同时生成1molCH3OH时,不能说明反应已达到平衡状态,故d符合;
故选ad;
(4)甲醇燃料电池通入燃料甲醇的一极为负极,即Pt(a)电极为负极,通入氧气的一极为正极,即Pt(b)电极为正极,电解质溶液为稀硫酸,
①Pt(b)电极为正极,发生还原反应,电极反应式为O2+4e-+4H+=2H2O;
②Pt(a)电极为负极,发生氧化反应,电极反应式为![]() ,由关系式
,由关系式![]() 可知,如果该电池工作时导线中通过3mol电子,则理论上消耗甲醇的物质的量为0.5mol。
可知,如果该电池工作时导线中通过3mol电子,则理论上消耗甲醇的物质的量为0.5mol。

【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表:下列说法正确的是( )
2Z(g),各组分在不同时刻的浓度如下表:下列说法正确的是( )
物质 | X | Y | Z |
初始浓度(mol/L) | 0.1 | 0.2 | 0 |
2min末浓度(mol/L) | 0.08 | a | b |
平衡浓度(mol/L) | 0.05 | 0.05 | 0.1 |
A.平衡时,X的转化率为20%
B.t℃时,2min末Y与Z的物质的量浓度:a=0.06mol/L,b=0.4mol/L
C.增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动
D.前2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol/(L·min)
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D