题目内容
【题目】钠、铝和铁是三种重要的金属。请回答:
(1)当前,产量最高,用途最广的金属是_____________。
(2)这三种金属的金属活动性由强到弱的顺序是_______________ 。
(3)硫酸铁有净水的作用。写出硫酸铁的电离方程式:_____________ 。
(4)小块金属钠投入水中,发生反应的化学方程式为_____________;可观察到的实验现象是_____(填字母)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动d.水变红色
(5)足量的铝与氢氧化钠溶液反应后得到标准状况下的氢气2.24L,则参加反应的铝的质量为_____ 。
【答案】铁 钠>铝>铁 Fe2(SO4)3=2Fe3++3SO42- 2Na+2H2O=2NaOH+H2↑ bc 1.8g
【解析】
(1)当前,产量最高,用途最广的金属是铁。
(2)按照金属活动性顺序表,这三种金属的金属活动性由强到弱的顺序是钠>铝>铁。
(3)硫酸铁在水中能电离出的Fe3+发生水解生成Fe(OH)3胶体,能吸附水中的杂质,有净水的作用。硫酸铁的电离方程式为Fe2(SO4)3=2Fe3++3SO42-。
(4)金属钠投入水中,生成NaOH和氢气,发生反应的化学方程式为2Na+2H2O=2NaOH+H2↑;钠比水轻,会浮在水面上,钠和水反应放出大量的热,同时由于钠的熔点低,所以可观察到钠熔成一个闪亮的小球,生成的氢气使小球四处游动,并伴随有嘶嘶的响声,没有向水中滴酚酞,所以不能观察到溶液变红,故选bc。
(5)根据铝和氢氧化钠溶液反应的化学方程式:
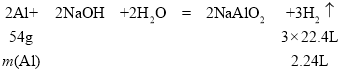
m(Al)=1.8g。

练习册系列答案
相关题目