题目内容
1.请根据化学方程式计算:(1)完全中和0.3mol氢氧化钠,需要硫酸的物质的量是多少?需要物质的量浓度为3mol•L-1稀硫酸多少升?(要求写出计算过程)
(2)质量分数为98%、密度为1.84g•mL-1的浓硫酸的物质的量浓度是多少?若由此浓硫酸来稀释成3mol•L-1稀硫酸,需要该浓硫酸多少毫升?(要求写出计算过程)
分析 (1)发生反应:2NaOH+H2SO4=Na2SO4+2H2O,根据方程式计算消耗硫酸物质的量,再根据V=$\frac{n}{c}$计算需要稀硫酸的体积;
(2)根据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,再根据稀释定律计算需要浓硫酸的体积.
解答 解:(1)设需要硫酸的物质的量为n,则:
2NaOH+H2SO4=Na2SO4+2H2O
2 1
0.3mol n
所以n=$\frac{0.3mol×1}{2}$=0.15mol,
需要稀硫酸的体积为$\frac{0.15mol}{3mol/L}$=0.05L,
答:需要硫酸的物质的量是0.15mol,需要物质的量浓度为3mol•L-1稀硫酸0.05L;
(2)根据c=$\frac{1000ρω}{M}$可知,质量分数为98%、密度为1.84g•mL-1的浓硫酸的物质的量浓度是$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,根据稀释定律,需要浓硫酸的体积为$\frac{50mL×3mol/L}{18.4mol/L}$=8.15mL,
答:该浓硫酸的物质的量浓度是18.4mol/L,由此浓硫酸来稀释成3mol•L-1稀硫酸,需要该浓硫酸8.15毫升.
点评 本题考查化学方程式计算、物质的量浓度计算,比较基础,注意掌握物质的量浓度与质量分数之间关系.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
12.化学与人类生活密切相关.下列说法正确的是( )
| A. | 淀粉、脂肪和蛋白质都是人体必需的高分子化合物 | |
| B. | 汽油、柴油和植物油都是碳氢化合物 | |
| C. | 高压聚乙烯是无毒高分子化合物,可用作食品包装袋等薄膜制品 | |
| D. | 向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |
9.NA表示阿伏加德罗常数.下列说法正确的是( )
| A. | 7.8 g Na2O2中含有的阴离子数目为0.2NA | |
| B. | 足量Zn与一定量的浓硫酸反应,产生22.4L(标准状况)气体时转移的电子数一定为2NA | |
| C. | 1 L 0.1 mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA |
16.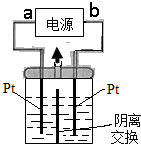 电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电后,发现左侧溶液变蓝色,一段时间后,蓝色又逐渐变浅.(已知:3I2+6OH-═IO3-+5I-+3H2O,IO3-离子无色);下列说法不正确的是( )
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电后,发现左侧溶液变蓝色,一段时间后,蓝色又逐渐变浅.(已知:3I2+6OH-═IO3-+5I-+3H2O,IO3-离子无色);下列说法不正确的是( )
 电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电后,发现左侧溶液变蓝色,一段时间后,蓝色又逐渐变浅.(已知:3I2+6OH-═IO3-+5I-+3H2O,IO3-离子无色);下列说法不正确的是( )
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电后,发现左侧溶液变蓝色,一段时间后,蓝色又逐渐变浅.(已知:3I2+6OH-═IO3-+5I-+3H2O,IO3-离子无色);下列说法不正确的是( )| A. | 右侧发生的电极反应式:2H2O+2e-═H2↑+2OH- | |
| B. | a为电源正极 | |
| C. | 电解结束时,右侧溶液中没有IO3- | |
| D. | 用阴离子交换膜,电解槽内发生的总化学方程式为:KI+3H2O$\frac{\underline{\;电解\;}}{\;}$ KIO3+3H2↑ |
6.在某固定容积的密闭容器中存在化学平衡:aA(g)?bB(g)+C(g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中错误的是( )
| A. | 若a=b+c时,B的物质的量分数不变 | B. | 若a<b+c时,A的转化率减小 | ||
| C. | 若a<b+c时,B的物质的量浓度减小 | D. | 若a>b+c时,A的物质的量分数减小 |
10.下列实验不能获得成功的是( )
①用甲烷气体通入碘水制碘甲烷
②甲烷和溴蒸气混合光照制取纯净的一溴甲烷
③用酒精灯加热甲烷气体制取炭黑和氢气.
①用甲烷气体通入碘水制碘甲烷
②甲烷和溴蒸气混合光照制取纯净的一溴甲烷
③用酒精灯加热甲烷气体制取炭黑和氢气.
| A. | 只有① | B. | 只有③ | C. | 只有② | D. | ①②③ |
11.实验室中需要配制1mol/L的NaCl溶液970mL,配制时应选用的容量瓶的规格是( )
| A. | 950mL 容量瓶 | B. | 500mL容量瓶 | ||
| C. | 1000mL 容量瓶 | D. | 任意规格的容量瓶 |

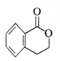
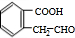
 +H2O$→_{△}^{稀H_{2}SO_{4}}$
+H2O$→_{△}^{稀H_{2}SO_{4}}$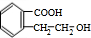 +CH3OH③F→G:2
+CH3OH③F→G:2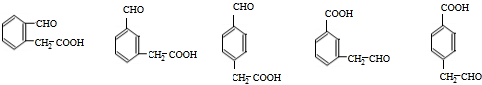 等
等