题目内容
【题目】Al及其化合物在现代工业中有广泛的用途。回答下列问题:
(1)下列状态的铝中,电离最外层的一个电子所需能量最小的是_____(填标号)。
A [Ne]3s1 B [Ne]3s2 C [Ne]3s23p1 D [Ne] 3s13p2
(2)熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6,二聚体Al2Cl6的结构式为_____(标出配位键);其中Al的配位数为_________。二聚体A12C16中Al原子的轨道杂化类型是________。
(3) 实际上,偏铝酸钠在水溶液中都是以Na[Al(OH)4]和形式存在,1mol Na[Al(OH)4]中含有σ键的数目为_________。
(4)Ga(镓)和铝是同一主族元素,Ga原子的电子排布式是___________。
【答案】D 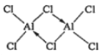 4 sp3 8NA [Ar]3d104s24p1
4 sp3 8NA [Ar]3d104s24p1
【解析】
(1)电离最外层的一个电子所需能量:基态>激发态,第一电离能<第二电离能<第三电离能,据此判断解答;
(2) 二聚体Al2Cl6中Al原子有空轨道,Cl可以提供孤电子对形成配位键;配合物中的配位数是指直接同中心离子(或原子)配位的原子数目;双分子Al2Cl6中Al原子形成4个σ键,没有孤对电子,杂化轨道数目为4;
(3) Na[Al(OH)4]是离子化合物,[Al(OH)4]-中,铝离子含有空轨道,水分子含有孤对电子对,铝离子与水分子之间形成配位键,铝离子配体数为4,1个OH-含1个O-H键,则[Al(OH)4]-含有8个σ键;
(4)Ga元素原子核外电子数为31,根据能量最低原理书写核外电子排布式。
(1)A.[Ne]3s1再失去一个电子为Al的第三电离能;
B.[Ne]3s2再失去一个电子为Al的第二电离能;
C.[Ne]3s23p1为基态铝原子核外电子排布式,失去一个电子为Al的第一电离能;
D.[Ne] 3s13p2为激发态铝原子核外电子排布式;
铝的第三电离能>第二电离能>第一电离能,基态大于激发态,所以电离最外层一个电子所需能量最小的为D,答案选D;
(2)熔融时AlCl3生成可挥发的二聚体Al2Cl6,该二聚体由Al提供空轨道,Cl原子提供电子对形成配位键,其结构式为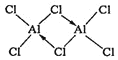 ;配合物中的配位数是指直接同中心离子(或原子)配位的原子数目,二聚体Al2Cl6中与Al直接相连的原子有4个,故其配位数为4;由双分子Al2Cl6的结构可知,分子中Al原子形成4个σ键,没有孤对电子,杂化轨道数目为4,Al原子采取sp3杂化;
;配合物中的配位数是指直接同中心离子(或原子)配位的原子数目,二聚体Al2Cl6中与Al直接相连的原子有4个,故其配位数为4;由双分子Al2Cl6的结构可知,分子中Al原子形成4个σ键,没有孤对电子,杂化轨道数目为4,Al原子采取sp3杂化;
(3)Na[Al(OH)4]是离子化合物,[Al(OH)4]-中,铝离子含有空轨道,水分子含有孤对电子对,铝离子与水分子之间形成配位键,铝离子配体数为4,1个OH-含1个O-H键,则[Al(OH)4]-含有8个σ键,1mol Na[Al(OH)4]中含有σ键的数目为8NA;
(4)Ga元素原子核外电子数为31,Ga基态原子的核外电子排布式是:1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1)。