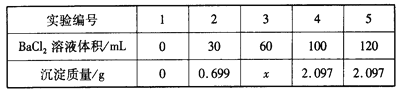
题目内容
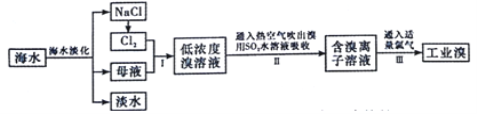
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图:
(1)除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序正确的是______.
A.NaOH溶液→碳酸钠溶液→氯化钡溶液→过滤后加盐酸
B.氯化钡溶液→氢氧化钠溶液→碳酸钠溶液→过滤后加盐酸
C.NaOH溶液→氯化钡溶液→碳酸钠溶液→过滤后加盐酸
D.碳酸钠溶液→氢氧化钠溶液→氯化钡溶液→过滤后加盐酸
(2)写出Ⅱ中发生反应的离子方程式:______.
(3)从理论上考虑,下列物质也能吸收的是______
A.NaOH![]()
![]()
![]()
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是______.
(5)已知某溶液中Cl-、Br-、I-的物质的量之比为3:4:5,现欲使溶液中的Cl-、Br-、I-的物质的量之比变成3:2:1,那么要通入氯气的物质的量是原溶液中I-的物质的量是______
A.1/2B.1/10C.3/10D.1/5
【答案】BCBr2+SO2+2H2O=4H++2Br-+SO42-ABCCl2>Br2>SO2C
【解析】
海水淡化得到淡水和氯化钠,电解氯化钠溶液生成氯气,氯气通入母液中发生反应得到低浓度的溴单质溶液,通入热空气吹出后用二氧化硫水溶液吸收得到含HBr和硫酸的溶液,通入适量氯气氧化得到溴单质,富集溴,蒸馏得到工业溴,(1)除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,盐酸要放在最后,以除去过量的氢氧化钠和碳酸钠,应该先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子,即:加入的碳酸钠溶液必须放在加入氯化钡溶液之后;(2)Ⅱ中发生反应是溴单质氧化二氧化硫生成硫酸;(3)溴单质和氢氧化钠溶液反应,或和还原性的物质发生氧化还原反应;(4)氧化还原反应方程式中:氧化性:氧化剂大于氧化产物,氧化剂大于还原剂;(5)已知还原性I->Br->Cl-,反应后I-有剩余,说明Br-浓度没有变化,通入的Cl2只与I-发生反应,根据反应的方程式2I-+Cl2=2Cl-+I2计算。
(1)要先除SO42-离子,然后再除Ca2+离子,碳酸钠可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,至于加NaOH除去Mg2+离子顺序不受限制,因为过量的氢氧化钠加盐酸就可以调节了,只要将三种离子除完了,然后过滤即可,最后加盐酸除去过量的氢氧根离子、碳酸根离子,所以正确的操作顺序为:A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸,最后加入的氯化钡溶液中钡离子不能除去,选项A错误;B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸,选项B正确;C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸,选项C正确;D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸,顺序中加入的氯化钡溶液中钡离子无法除去,选项D错误;答案选BC;
(2)Ⅱ中发生反应是溴单质氧化二氧化硫生成硫酸,反应的离子方程式为:Br2+SO2+2H2O=4H++2Br-+SO42-;
(3)A.NaOH溶液和溴单质反应生成溴化钠、次溴酸钠和水,可以吸收,选项A正确;B.FeCl2 溶液具有还原性,可以被溴单质氧化为氯化铁,可以吸收溴单质,选项B正确;C.Na2SO3 溶液具有还原性,可以被溴单质氧化,能吸收溴单质,选项C正确;D.H2O和溴单质反应微弱,不能充分吸收溴单质,选项D错误;答案选ABC;
(4)Cl2+2Br-=Br2+2Cl-,根据氧化还原反应中氧化性:氧化剂大于氧化产物,所以氧化性:Cl2>Br2;Br2+SO2 +2H2O=H2SO4 +2HBr,根据氧化还原反应中氧化性:氧化剂大于还原剂,所以氧化性:Br2>SO2;故答案为:Cl2>Br2>SO2;
(5)已知还原性I->Br->Cl-,反应后I-有剩余,说明Br-浓度没有变化,通入的Cl2只与I-发生反应,设原溶液中含有3molCl-,4molBr-,5molI-,通入Cl2后,它们的物质的量之比变为3:2:1,即6:4:2,此时氯离子增大3mol,碘离子减少3mol,溴离子不变,则各离子物质的量分别为:6molCl-,4molBr-,2molI-,Cl-增加3mol,I-离子减少3mol,Br-不变,则需1.5molCl2,则通入的Cl2物质的量是原溶液中I-物质的量的 ![]() =
=![]() ,答案选C。
,答案选C。

 阅读快车系列答案
阅读快车系列答案