题目内容
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成气态分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期元素中原子半径最大的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13 个电子。则
(1)B的原子结构示意图为 ;X的化学名称为 。
(2)B单质的电子式为 ;E的气态氢化物的结构式为 ;C与D形成的两种化合物中,原子个数比为1:1的那种物质所含有的化学键为 ,该物质属于 (填“离子化合物”或“共价化合物”)。
(3)B、C、E分别与A形成的化合物中最稳定的是 (写化学式)。
(4)D是同周期简单阳离子中离子半径最 的元素。
(5)F的单质在反应中常作 剂(填“氧化”或“还原”)。
【答案】(1)![]() 氨
氨
(2)![]() H—S—H 离子键、共价键 离子化合物
H—S—H 离子键、共价键 离子化合物
(3)H2O(4)大(5)氧化
【解析】试题分析:A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性,所以X为NH3,A的原子序数比B小,则B为N元素,A为H元素;D的简单阳离子与X具有相同电子数,NH3含有10个电子,D的简单阳离子为10e-结构,且D是同周期中原子半径最大的元素,则D为Na元素;E元素的原子最外层比次外层少两个电子,E的原子序数大于Al,则E有3个电子层,最外层电子数为6,则E为S元素;F的原子序数比E大且为短周期主族元素,则F是Cl元素;C、F两种元素的原子最外层共有13个电子,C最外层有6个电子,原子序数比Na小,则C为O元素,则
(1)B为N元素,原子核外电子数是7,有2个电子层,最外层有5个电子,原子结构示意图为![]() ;X的化学名称为氨气;
;X的化学名称为氨气;
(2)B单质为N2,N原子之间形成3对共用电子对,其电子式为![]() ;E的气态氢化物为H2S,氢原子与硫原子之间形成1对共用电子对,其结构式为H-S-H;C与D形成的两种化合物为Na2O、Na2O2,其中一种物质含有两种类型的化学键,该物质为Na2O2,含有离子键、共价键,属于离子化合物;
;E的气态氢化物为H2S,氢原子与硫原子之间形成1对共用电子对,其结构式为H-S-H;C与D形成的两种化合物为Na2O、Na2O2,其中一种物质含有两种类型的化学键,该物质为Na2O2,含有离子键、共价键,属于离子化合物;
(3)N、O、S三元素中O的非金属性最强,故分别与H形成的化合物中最稳定的是H2O;
(4)D为Na元素,是同周期简单阳离子中核电荷数最小的元素,故同周期简单阳离子中Na+离子半径最大;
(5)F是Cl元素,其单质具有强氧化性,在反应中常作氧化剂。

【题目】(1)下列仪器: ①烧杯 ②蒸馏烧瓶 ③冷凝管 ④普通漏斗 ⑤分液漏斗 ⑥蒸发皿 ⑦玻璃棒 ⑧铁架台(带铁圈、铁夹) ⑨酒精灯 ⑩温度计
①在过滤时需要用到的有 (填序号,下同)。
②在蒸馏时需要用到的有 。
③在萃取时需要用到的有 。
④在蒸发结晶时需要用到的有 。
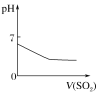
(2)用CCl4萃取碘水中的碘在右图的分液漏斗中,下层液体呈________色;他们打开分液漏斗活塞,却未见液体流下,原因可能是______________________。
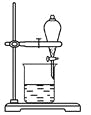
(3)某同学用某种粗盐进行提纯实验,步骤见下图。
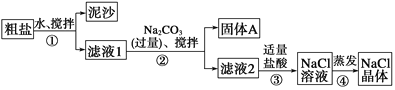
请回答下列问题:
①步骤①和②的操作名称是________。
②步骤③判断加入盐酸“适量”的方法是______________;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止____________,当蒸发皿中有较多量固体出现时,应________,用余热使水分蒸干。
③猜想和验证:
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | _________ | 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入__________,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | ___________ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,____________ | _________ | 猜想Ⅲ成立 |