题目内容
(10分)
(1)质量相同的O2、NH3、H2、Cl2四种气体中,在相同温度和相同压强条件下,体积最大的是 。
(2)下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是_______。(填序号)
①NaAlO2 ② Ca(OH)2 ③Na2CO3 ④Al(OH)3
(3)氯水中含有多种成分。将紫色石蕊试液滴入氯水中,溶液显红色起作用的成分是
;过一会儿,溶液颜色逐渐褪去,起作用的成分是 ;
(4)标准状况下把11.2L氯气通入500ml0.8mol/LFeBr2溶液中,写出反应完全后的离子方程式 。
(1) H2 (2)④ (3)HCl或H+、HClO
(4)5Cl2+4Fe2++6Br―=10Cl-+4Fe3++3Br2
解析试题分析:(1)质量相同的O2、NH3、H2、Cl2四种气体中,由V= ×Vm可知,质量相同时,气体体积与摩尔质量成反比,体积最大的是气体摩尔质量最小的,即氢气。
×Vm可知,质量相同时,气体体积与摩尔质量成反比,体积最大的是气体摩尔质量最小的,即氢气。
(2)物质中即与酸反应又与碱反应的主要有:特殊的单质(Al、Zn、Cl2、S、Si 等)、两性化合物(ZnO、AI2O3、Al(OH)3等)、弱酸的酸式盐(NaHS、NaHCO3等)、弱酸的铵盐(NH4)2CO3等)、部分化合物(SO2、NO2等)、氨基酸。
(3)氯水溶液中存在反应:Cl2+H2O?HCl+HClO,是可逆反应,存在电离:H2O H++OH-、HClO
H++OH-、HClO H++ClO-,HCl═H++Cl-,所以溶液中存在的微粒有:分子:Cl2、HClO、H2O;离子:H+、Cl-、ClO-、OH-。酸能使紫色石蕊试液变红色,在水溶液里电离出的阳离子全部是氢离子的是酸,所以使紫色石蕊试液变红色的微粒是氢离子;次氯酸有漂白性,所以红色溶液逐渐褪色,起作用的微粒是次氯酸分子。
H++ClO-,HCl═H++Cl-,所以溶液中存在的微粒有:分子:Cl2、HClO、H2O;离子:H+、Cl-、ClO-、OH-。酸能使紫色石蕊试液变红色,在水溶液里电离出的阳离子全部是氢离子的是酸,所以使紫色石蕊试液变红色的微粒是氢离子;次氯酸有漂白性,所以红色溶液逐渐褪色,起作用的微粒是次氯酸分子。
(4)将a mol Cl2通入含b mol FeBr2的溶液中,还原性Fe2+>Br―,所以通入氯气,Fe2+先被氯气氧化,反应完后再通氯气,Br―被氧化。所以当0< a / b≤1/2时,只有Fe2+被氧化,所以发生反应2Fe2++Cl2 =2Fe3++2Cl-;当 a / b =1时,Fe2+全部被氧化,Br―是Fe2+的2倍,只有1半被氧化,所以发生的反应方程式为2Cl2+2Fe2++2Br―= 2Fe3++Br2+4Cl―;当a / b≥3/2时,Fe2+、Br―全部被氧化,所以反应为3Cl2+2Fe2++4Br―=2Fe3++2Br2+6Cl―。标准状况下把11.2L氯气物质的量是0.5mol,500ml0.8mol/LFeBr2物质的量是0.4mol,氯气与FeBr2的物质的量比是5:4,介于1/2和3/2之间,Fe2+全部被氧化,Br―有剩余所以氯气与Fe2+全部反应完,得5Cl2+4Fe2++Br― Fe3++Br2+Cl―,根据电荷守恒和原子守恒既得5Cl2+4Fe2++6Br―=10Cl-+4Fe3++3Br2。
Fe3++Br2+Cl―,根据电荷守恒和原子守恒既得5Cl2+4Fe2++6Br―=10Cl-+4Fe3++3Br2。
考点:考查阿伏伽德罗定律,氯水的性质等。

 阅读快车系列答案
阅读快车系列答案在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 | 质量(g) | 摩尔质量(g·mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.87 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.075 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
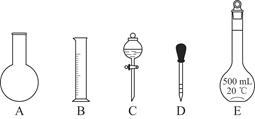
(2)配制一定物质的量浓度的上述“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、 、_________、________。
(3)在溶液配制过程中,下列操作对配制结果没有影响的是 。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为 mol/L。