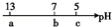题目内容
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
实验:向2 mL FeCl2溶液中滴加2滴0.1 mol•L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol•L-1、pH约为5(酸性环境)),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示实验中溶液变红的原因: 、 。
(2)甲探究实验中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 mol•L-1 FeCl3溶液中滴加2滴0.1 mol•L-1 KSCN溶液,变红,通入O2,无明显变化。
① 实验I说明 ;②实验III说明 。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目


 和SO
和SO 离子数之比为1 : 3时,正好完全发生氧化还原反应,X在还原产物中的化合价为
离子数之比为1 : 3时,正好完全发生氧化还原反应,X在还原产物中的化合价为
 逐渐减小,图中a、b、c三点的pH为实验中所测得。下列有关说法中一定正确的是
逐渐减小,图中a、b、c三点的pH为实验中所测得。下列有关说法中一定正确的是