题目内容
已知断开1 molH2中的化学键需吸收436kJ的热量,断开1 molCl2中的化学键需吸收243kJ的热量,而形成1 molHCl分子中的化学键需释放431kJ的热量,则1mol氢气与1mol氯气反应时能量变化为( )
| A.吸收183KJ | B.吸收248KJ | C.放出183KJ | D.放出366KJ |
C
试题分析:反应热就是断键吸收的能量和形成化学键所放出的能量的差值。根据题意可知,1mol氢气和氯气在断键时需要吸收的能量是436kJ+243kJ=679kJ。生成2mol氯化氢时放出的热量是431kJ×2=862kJ,所以该反应实际放出的热量是862kJ-679kJ=183KJ,答案选C。
点评:该题是常识性知识的考查,主要是考查学生对反应热与化学键键能关系以及反应热计算的熟悉了解程度,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的规范答题能力。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 、
、 、CO等大气污染气体的测量及处理具有重要意义。
、CO等大气污染气体的测量及处理具有重要意义。 可使
可使 等氧化,常用于定量测定CO的含量。已知:
等氧化,常用于定量测定CO的含量。已知:
 反应生成
反应生成 的热化学方程式:________________。
的热化学方程式:________________。

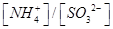 ________2(填“>”“<”或“=”)
________2(填“>”“<”或“=”) 可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将
可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将 还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。 (NH4)2CO3(aq) △H1
(NH4)2CO3(aq) △H1
 O2(g)===CO(g) △H2
O2(g)===CO(g) △H2
 CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ·mol-1 HCO3-+H+的电离平衡常数Ka1= 。(已知:10-5.60=2.5×10-6)
HCO3-+H+的电离平衡常数Ka1= 。(已知:10-5.60=2.5×10-6)