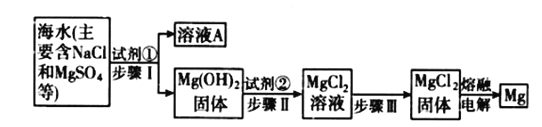
题目内容
【题目】燃烧1 g乙炔生成二氧化碳和液态水,放出热量50 kJ,则这一反应的热化学方程式为
A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=+50 kJ·mol1
B.C2H2(g)+![]() O2(g)===2CO2(g)+H2O(l) ΔH=1 300 kJ
O2(g)===2CO2(g)+H2O(l) ΔH=1 300 kJ
C.2C2H2+5O2===4CO2+2H2O ΔH=2 600 kJ
D.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=2 600 kJ·mol1
【答案】D
【解析】本题考查了热化学方程式的书写及简单计算。热化学方程式前面的化学计量数表示物质的量,反应热单位是 kJ·mol1,B和C均错;2 mol C2H2燃烧放出的热量为2×26×(50) kJ·mol1=2 600 kJ·mol1,D对。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
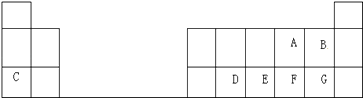
【题目】下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | B | ||||||
2 | D | E | F | G | ||||
3 | C | H | I |
(1)C的离子结构示意图为 , I的原子结构示意图 .
(2)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为;该物质溶于水后的溶液呈性(填“酸”、“碱”或“中”).
(3)元素的最高价氧化物对应的水化物中,碱性最强的是 , 该碱化学键类型 , 酸性最强的是 , 呈两性的是 .
(4)A分别与D,E,F,G H形成的化合物的稳定性顺序为: .