��Ŀ����
����Ŀ����2017����ģ�⡿ij�¶��£���2L�ܱ�������Ͷ��һ������A��B������Ӧ��3A(g)+bB (g)cC(g)��H=��Q kJmol��1(Q��0)��12s ʱ�ﵽƽ�⣬����C�����ʵ���Ϊ0.8mol����Ӧ������ͼ��ʾ������˵����ȷ����( )

A��ǰ12s�ڣ�A��ƽ����Ӧ����Ϊ0.025molL��1s��1
B��12s��A���������ʵ���B����������
C����ѧ������֮��b��c=1��2
D��12s�ڣ�A��B��Ӧ�ų�������Ϊ0.2Q kJ
���𰸡�C
��������ij�¶��£���2L�ܱ�������Ͷ��һ������A��B������Ӧ��3A(g)+bB (g)cC(g)��H=��Q kJmol��1(Q��0)��12s ʱ�ﵽƽ�⣬����C�����ʵ���Ϊ0.8mol��A��ͼ�������֪A��Ũ�ȱ仯=0.8mol/L��0.2mol/L=0.6mol/L����Ӧ����v=![]() =
=![]() =0.05mol/(Ls)����A����B��ͼ�����B��Ũ�ȱ仯=0.5mol/L��0.3mol/L=0.2mol/L������B�ķ�Ӧ����=
=0.05mol/(Ls)����A����B��ͼ�����B��Ũ�ȱ仯=0.5mol/L��0.3mol/L=0.2mol/L������B�ķ�Ӧ����=![]() =
=![]() ������֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�3��b=0.05��
������֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�3��b=0.05��![]() ��b=1��3��c=0.05��
��b=1��3��c=0.05��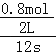 ��c=2����ѧ����ʽ��AB��������ͬ��12s��ﵽƽ��״̬��A���������ʲ�����B���������ʣ���B����C��ͼ�����B��Ũ�ȱ仯=0.5mol/L��0.3mol/L=0.2mol/L������B�ķ�Ӧ����=
��c=2����ѧ����ʽ��AB��������ͬ��12s��ﵽƽ��״̬��A���������ʲ�����B���������ʣ���B����C��ͼ�����B��Ũ�ȱ仯=0.5mol/L��0.3mol/L=0.2mol/L������B�ķ�Ӧ����=![]() =
=![]() ������֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�3��b=0.05��
������֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�3��b=0.05��![]() ��b=1��3��c=0.05��
��b=1��3��c=0.05�� ��c=2����ѧ������֮��b��c=1��2����C��ȷ��D.12s�ڷ�Ӧ3molA����QKJ����ӦA�����ʵ���=(0.8mol/L��0.2mol/L)��2L=1.2mol����ϻ�ѧ����ʽ������ϵ���㣬3A(g)+B (g)2C(g)��H=��Q kJmol��1��1.2molA��Ӧ�ų�����0.4QKJ����D����ѡC��
��c=2����ѧ������֮��b��c=1��2����C��ȷ��D.12s�ڷ�Ӧ3molA����QKJ����ӦA�����ʵ���=(0.8mol/L��0.2mol/L)��2L=1.2mol����ϻ�ѧ����ʽ������ϵ���㣬3A(g)+B (g)2C(g)��H=��Q kJmol��1��1.2molA��Ӧ�ų�����0.4QKJ����D����ѡC��

 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�