题目内容
【题目】孔雀石的主要成分为Cu2(OH)2CO3,还含少量二价铁和三价铁的氧化物及硅的氧化物。以下是实验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:
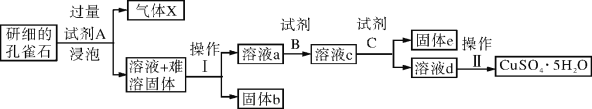
(1)试剂A的化学式是_____________;操作Ⅰ的名称是______________;
(2)生成气体X的化学方程式为:_________________________________。
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B最好选用_________
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)已知:
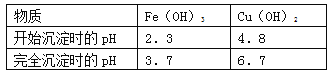
①试剂C的使用是为了调节溶液的pH,使Fe3+转化为沉淀予以分离。试剂C宜选用__________:
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuO
②为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为__________。
(5)请设计一种实验方案检验溶液中Fe3+是否完全除去(写出操作步骤、现象和结论) ______。
【答案】(1)H2SO4 过滤;
(2)Cu2(OH)2CO3+2H2SO4===2CuSO4+3H2O+CO2↑。
(3)B;
(4)D;3.7~4.8
(5)取待检溶液少许,加入KSCN溶液,若溶液不变红色,说明Fe3+已完全除去;若溶液变红色,则说明Fe3+未完全除去
【解析】
试题分析:(1)Cu2(OH)2CO3可与酸反应生成二氧化碳气体,目的是制备CuSO4·5H2O晶体,试剂A的化学式是H2SO4;操作Ⅰ是把固体与液体分离,所以操作Ⅰ的名称是过滤;
(2)Cu2(OH)2CO3与硫酸反应生成二氧化碳的化学方程式为:Cu2(OH)2CO3+2H2SO4==2CuSO4+3H2O+CO2↑。
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,双氧水为绿色氧化剂发生还原反应的产物是水,试剂B最好选用双氧水,答案选B。
(4)①CuO可与酸反应,使溶液的pH增大,由于不能引入新杂质,所以 C宜选用CuO,答案选D。
②根据表格数据,为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为 3.7~4.8。
(5)Fe3+与KSCN溶液反应生成红色溶液,所以取待检溶液少许,加入KSCN溶液,若溶液不变红色,说明Fe3+已完全除去;若溶液变红色,则说明Fe3+未完全除去。

 中考解读考点精练系列答案
中考解读考点精练系列答案