题目内容
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01mol.L-1)溶液的PH和原子序数的关系如下图所示。

(1)元素R在周期表中的位置是 。
(2)元素Y和W形成的Y2W2型化合物中含有化学键的类型为 。
(3)测定Z元素最高价氧化物对应水化物溶液物质的量浓度的方法为 。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等
(1)下列能说明碳、硫两种元素非金属性相对强弱的是 (填序号)
A.相同条件下水溶液的PH:Na2CO3>Na2SO4
B.酸性:H2SO3 >H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
(2)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似
①羰基硫(COS)的电子式为: 。
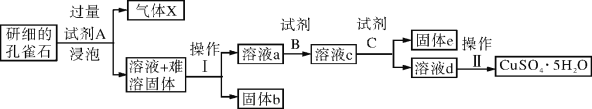
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下:

已知A是一种正盐,则A的化学式为 ;若气体a为单质,反应 II的离子方程式为 。
【答案】I.(1)第三周期第ⅦA族
(2)离子键、非极性共价键
(3)酸碱中和滴定
II.(1)ac (2)①![]() ②Na2CO32S2-+5H2O
②Na2CO32S2-+5H2O![]() S2O32-+4H2↑+2OH-
S2O32-+4H2↑+2OH-
【解析】试题分析:I.据题意X、Y、Z、W、R是短周期主族元素且原子序数依次增大,最高价氧化物对应的水化物(浓度均为0.01mol.L-1)溶液的PH,Y对应PH=12,说明Y是钠,X对应PH=2,X是氮,Z对应PH>2,所以 Z 是磷,W对应PH<2,所以W是S;R对应PH=2原子序数最大,所以R是Cl。
(1)元素R在周期表中的位置是:第三周期第ⅦA族。
(2)元素Y和W形成的Y2W2型化合物是Na2S2中含有化学键的类型为:离子键、非极性共价键。
(3)测定Z元素最高价氧化物对应水化物溶液磷酸物质的量浓度的方法为:酸碱中和滴定。
II.(1)A.Na2CO3水解呈碱性,说明H2CO3是弱酸,Na2SO4不水解,H2SO4是强酸,所以H2SO4的酸性强于H2CO3的,则能说明碳与硫两元素非金属性相对强弱关系为:S>C,a正确;B.酸性:H2SO3 >H2CO3,亚硫酸不是最高价含氧酸,不能说明碳与硫两元素非金属性相对强弱,b错误;c、直接说明S的非金属性强于C,所以S才显负价,碳元素显示正价,c正确。
(2)①羰基硫(COS)的电子式为:![]() ;②COS与氢氧化钠反应,根据原子守恒,A溶液应该是含C的正盐,所以是Na2CO3;②据原子守恒,气体a应该是氢气,所以反应为:2S2-+5H2O=S2O32-+4H2+2OH-。
;②COS与氢氧化钠反应,根据原子守恒,A溶液应该是含C的正盐,所以是Na2CO3;②据原子守恒,气体a应该是氢气,所以反应为:2S2-+5H2O=S2O32-+4H2+2OH-。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】下表是元素周期表的一部分。表中所列字母分别代表某一化学元素。

(1)下列 (填写编号)组元素的单质具有良好导电性。
①a、c、m ②b、g、k ③c、h、1 ④d、e、f
(2)电离能主要取决于原子核对核外电子的吸引力和形成稳定结构的倾向。下表是一些气态原子各级电离能的数据(kJ·mol-1):
锂 | X | Y | |
失去一个电子 | 519 | 502 | 580 |
失去二个电子 | 7296 | 4570 | 1820 |
失去三个电子 | 11799 | 6920 | 2750 |
失去四个电子 | 9550 | 11600 |
①为什么锂原子的第二电离能远远大于第一电离能 。
②用电子式表示X和j以原子个数1比1形成的一种化合物 。
③Y在周期表中是 族元素。
④e元素的电子排布式为