题目内容
【题目】硅是人类文明发展的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)工业生产粗硅的反应有:SiO2+2C![]() Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C![]() SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
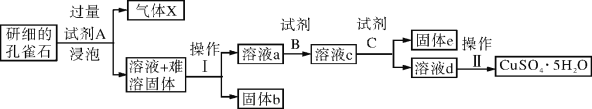
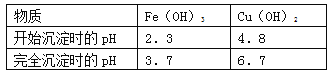
(2)工业上可以通过如下图所示的流程制取纯硅:
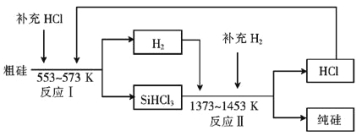
①若反应I为 Si(粗)+3HCl![]() SiHCl3+H2,则反应II的化学方程式为 。
SiHCl3+H2,则反应II的化学方程式为 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另 一种物质,写出该反应的化学方程式: 。
③设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是 。
【答案】(1)1:2(2)①SiHCl3+H2![]() Si(纯)+3HCl
Si(纯)+3HCl
②SiHCl3+3H2O=H2SiO3+3HCl+H2↑ ③5:1
【解析】
试题分析:(1)将两方程式叠加,可知C和SiO2的物质的量之比为5:2,因此质量比为:(5×12):(2×60)=1:2。
(2)①由流程图可知反应II是SiHCl3和H2反应生成纯硅和HCl,因此方程式为SiHCl3+H2![]() Si(纯)+3HCl。
Si(纯)+3HCl。
②写出方程式中已知物质:SiHCl3+3H2O — H2SiO3+3HCl,由原子守恒可知另一种物质为H2,因此反应的化学方程式为SiHCl3+3H2O=H2SiO3+3HCl+H2↑。
③由题中条件可知:
Si(粗)+ 3HCl ![]() SiHCl3 + H2
SiHCl3 + H2
1mol 3mol 1mol
SiHCl3+H2 ![]() Si(纯)+3HCl
Si(纯)+3HCl
1mol 1mol 3mol
由以上数据可知循环生产中只能产生3molHCl,但HCl的利用率是90%,因此需要增加(![]() )molHCl,循环生产中只产生1molH2,但H2的利用率为93.75%,因此需增加(
)molHCl,循环生产中只产生1molH2,但H2的利用率为93.75%,因此需增加(![]() )molH2,所以补充投入HCl 和H2的物质的量之比为:(
)molH2,所以补充投入HCl 和H2的物质的量之比为:(![]() ):(
):(![]() )=5:1。
)=5:1。