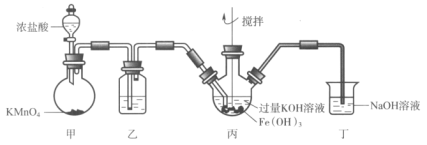
题目内容
【题目】现有一定量的镁铝合金与![]() 稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入
稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入![]() NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。下列说法 不正确的是
NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。下列说法 不正确的是
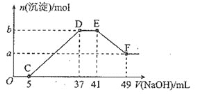
A.![]()
B.OC段反应的离子方程式为![]()
C.D点对应溶液中的溶质为![]() 和
和![]()
D.原![]() 溶液中溶质的物质的量浓度为
溶液中溶质的物质的量浓度为![]()
【答案】D
【解析】
根据题意可知,反应始终没有气体生成,说明没有氮的氧化物生成,由于金属化合价升高,推测N元素化合价只能由+5变成了-3价,由图象可知硝酸过量,加入氢氧化钠溶液应先与剩余的硝酸反应,之后再生成氢氧化镁、氢氧化铝沉淀;当沉淀完全后继续加入NaOH溶液,沉淀量不变,说NaOH与NH4+发生反应,NH4+反应完全氢氧化铝沉淀开始溶解,直至最后剩余氢氧化镁沉淀,据此结合发生反应及质量守恒解答。
A、b与a的差值为氢氧化铝的物质的量,由图可知,EF段消耗的氢氧化钠溶液为![]() ,故该阶段参加反应的氢氧化钠为
,故该阶段参加反应的氢氧化钠为![]() ,
,
根据![]()
![]() 可知,
可知,![]() 的物质的量为
的物质的量为![]() ,故A正确;
,故A正确;
B、OC段反应的离子方程式为:![]() ,故B正确;
,故B正确;
C、D点对应溶液为![]() 和
和![]() 的混合溶液,C项正确;
的混合溶液,C项正确;
D、DE段发生反NH4++OH-═NH3H2O,![]() ,E点对应溶液为
,E点对应溶液为![]() 和
和![]() 的混合溶液,溶液中
的混合溶液,溶液中![]() ,根据N原子守恒,原
,根据N原子守恒,原![]() 溶液中溶质的物质的量浓度为
溶液中溶质的物质的量浓度为![]() ,D项错误。
,D项错误。
答案选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是( )
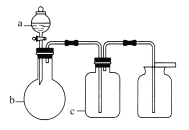
选项 | 气体 | a | b | c |
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
B | SO2 | 70%的浓H2SO4 | Na2SO3固体 | 98%的浓H2SO4 |
C | NO | 稀HNO3 | 铜屑 | H2O |
D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A.AB.BC.CD.D