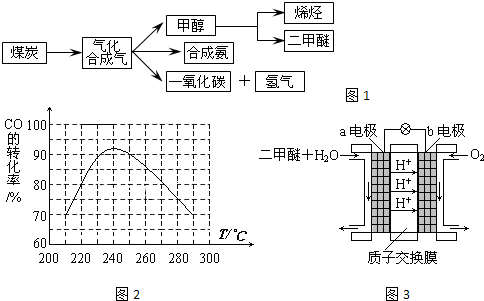
题目内容
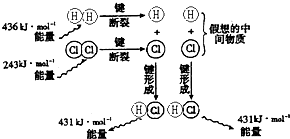 如图为H2(g)+Cl2(g)═2HCl(g)反应的能量变化示意图.据图判断,下列叙述中正确的是( )
如图为H2(g)+Cl2(g)═2HCl(g)反应的能量变化示意图.据图判断,下列叙述中正确的是( )分析:化学反应中,化学键断裂要吸收能量,形成化学键要放出能量,由键能大小可知H2(g)+Cl2(g)═2HCl(g)的反应热,生成2molHCl,化学键断裂吸收热量:436kJ+243kJ=679kJ,
形成化学键放出热量:2×431kJ=862kJ,则反应放热,并根据H2、Cl2、HCl中,H的最外层电子数为2来解答.
形成化学键放出热量:2×431kJ=862kJ,则反应放热,并根据H2、Cl2、HCl中,H的最外层电子数为2来解答.
解答:解:A.氢气和氯气反应生成氯化氢气体的热化学方程式是:H2(g)+Cl2(g)═2HCl(g)△H=(436kJ/mol+243kJ/mol)-2×431kJ/mol=-183kJ/mol,故A错误;
B.436kJ?mol-1是H-H断裂吸收的能量,不是氢气的燃烧热,故B错误;
C.氢气可在点燃或光照条件下与氯气反应,强光照射能加反应速率,故C正确;
D.H2、Cl2、HCl中,H的最外层电子数为2,Cl的最外层电子数为8,H2、HCl中H原子只达到最外层2个电子稳定结构,故D错误.
故选C.
B.436kJ?mol-1是H-H断裂吸收的能量,不是氢气的燃烧热,故B错误;
C.氢气可在点燃或光照条件下与氯气反应,强光照射能加反应速率,故C正确;
D.H2、Cl2、HCl中,H的最外层电子数为2,Cl的最外层电子数为8,H2、HCl中H原子只达到最外层2个电子稳定结构,故D错误.
故选C.
点评:本题考查较为综合,题目难度不大,本题注意从键能角度计算反应热的方法,注意燃烧热的概念.

练习册系列答案
相关题目
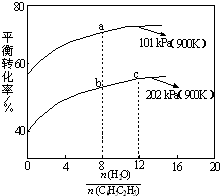 苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g)?C6H5CH=CH2(g)+H2(g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),如图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系.下列说法正确的是( )
苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g)?C6H5CH=CH2(g)+H2(g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),如图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系.下列说法正确的是( )| A、a点转化率为75%,若起始向1 L恒容容器中充入1 mol 乙苯,则平衡常数为2.25 | ||
B、b点转化率为50%,则混合气体中苯乙烯的体积分数为
| ||
| C、恒容时加入稀释剂能减小C6H5C2H5平衡转化率 | ||
| D、b点和c点温度和压强相同,所以反应速率也相等 |
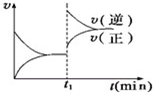 (2008?湖南模拟)如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是( )
(2008?湖南模拟)如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是( )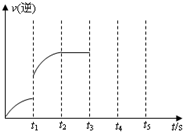 (2012?河东区一模)一定温度下在体积为5L的密闭容器中发生可逆反应.
(2012?河东区一模)一定温度下在体积为5L的密闭容器中发生可逆反应. CO(g)+H2(g)
CO(g)+H2(g)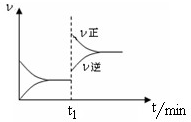 如图为某化学反应的速率与时间的关系示意图.下列有关t1时刻改变条件的说法正确的是( )
如图为某化学反应的速率与时间的关系示意图.下列有关t1时刻改变条件的说法正确的是( )