题目内容
 苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g)?C6H5CH=CH2(g)+H2(g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),如图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系.下列说法正确的是( )
苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g)?C6H5CH=CH2(g)+H2(g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),如图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系.下列说法正确的是( )| A、a点转化率为75%,若起始向1 L恒容容器中充入1 mol 乙苯,则平衡常数为2.25 | ||
B、b点转化率为50%,则混合气体中苯乙烯的体积分数为
| ||
| C、恒容时加入稀释剂能减小C6H5C2H5平衡转化率 | ||
| D、b点和c点温度和压强相同,所以反应速率也相等 |
分析:A.计算乙苯的起始浓度以及乙苯的浓度变化量,利用三段式计算平衡时各组分的物质的量浓度,代入平衡常数表达式计算;
B.令开始投入乙苯的物质的量为1mol,计算参加反应的乙苯的物质的量,利用三段式计算平衡时各组分的物质的量,进而计算乙苯的体积分数;
C.恒容条件下,加入稀释剂水,不影响平衡移动;
D.体系总压强不变时,
越大,反应各物质浓度越小,相当于反应体系减压.
B.令开始投入乙苯的物质的量为1mol,计算参加反应的乙苯的物质的量,利用三段式计算平衡时各组分的物质的量,进而计算乙苯的体积分数;
C.恒容条件下,加入稀释剂水,不影响平衡移动;
D.体系总压强不变时,
| n(水) |
| n(乙苯) |
解答:解:A.若起始向1 L恒容容器中充入1 mol 乙苯,乙苯起始浓度为1mol/L,平衡时乙苯的转化率为50%,则乙苯浓度变化量=1mol/L×75%=0.75mol/L,则:
C6H5C2H5(g)?C6H5CH=CH2(g)+H2(g)
开始(mol/L):1 0 0
变化(mol/L):0.75 0.75 0.75
平衡(mol/L):0.25 0.75 0.75
故平衡常数=
=2.25,故A正确;
B.令开始投入乙苯的物质的量为1mol,则水蒸气的物质的量为8mol,b点转化率为50%,则参加反应乙苯的物质的量=1mol×50%=0.5mol,则:
C6H5C2H5(g)?C6H5CH=CH2(g)+H2(g)
开始(mol):1 0 0
变化(mol):0.5 0.5 0.5
平衡(mol):0.5 0.5 0.5
故平衡时混合体系总物质的量=8mol+0.5mol+0.5mol+0.5mol=9.5mol,故混合气体中苯乙烯的体积分数=
=
,故B正确;
C.恒容条件下,加入稀释剂水,反应混合物的浓度不变,不影响平衡移动,C6H5C2H5平衡转化率不变,故C错误;
D.体系总压强不变时,c点
值比b点大,故c点反应各物质浓度越小,相当于反应体系减压,c点反应速率比b小,故D错误,
故选AB.
C6H5C2H5(g)?C6H5CH=CH2(g)+H2(g)
开始(mol/L):1 0 0
变化(mol/L):0.75 0.75 0.75
平衡(mol/L):0.25 0.75 0.75
故平衡常数=
| 0.75×0.75 |
| 0.25 |
B.令开始投入乙苯的物质的量为1mol,则水蒸气的物质的量为8mol,b点转化率为50%,则参加反应乙苯的物质的量=1mol×50%=0.5mol,则:
C6H5C2H5(g)?C6H5CH=CH2(g)+H2(g)
开始(mol):1 0 0
变化(mol):0.5 0.5 0.5
平衡(mol):0.5 0.5 0.5
故平衡时混合体系总物质的量=8mol+0.5mol+0.5mol+0.5mol=9.5mol,故混合气体中苯乙烯的体积分数=
| 0.5mol |
| 9.5mol |
| 1 |
| 19 |
C.恒容条件下,加入稀释剂水,反应混合物的浓度不变,不影响平衡移动,C6H5C2H5平衡转化率不变,故C错误;
D.体系总压强不变时,c点
| n(水) |
| n(乙苯) |
故选AB.
点评:本题考查化学平衡及平衡常数计算、化学平衡图象等,注意恒压条件下加入稀释剂会使反应的各物质所占的分压降低(浓度降低),为易错题目.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
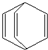 桶烯(Barrelene)结构简式如图所示,则下列有关说法不正确的是( )
桶烯(Barrelene)结构简式如图所示,则下列有关说法不正确的是( )| A、桶烯中的一个氢原子被氯原子取代,所得产物只有二种 | B、桶烯在一定条件下能发生加成反应和加聚反应 | C、桶烯与苯乙烯(C6H5CH=CH2)互为同分异构体 | D、桶烯分子中所有原子在同一平面内 |
有机物N结构简式如图所示,有关说法错误的是( )
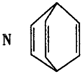

| A、N在一定条件下能发生加聚反应 | B、N分子中所有的原子在同一平面内 | C、N与苯乙烯(C6H5CH=CH2)互为同分异构体 | D、N中的一个氢原子被氯原子取代,所得产物只有两种 |
桶烯结构简式如图所示,有关说法不正确的是( )
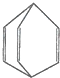

| A、桶烯分子中所有的原子不可能在同一平面上 | B、桶烯中的一个氢原子被氯原子取代,所得产物有三种 | C、桶烯与苯乙烯(C6H5CH═CH2)互为同分异构体 | D、桶烯在一定条件下能发生加成反应 |
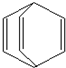 桶烯(Barrelene)结构简式如图所示,则下列有关说法不正确的是( )
桶烯(Barrelene)结构简式如图所示,则下列有关说法不正确的是( )