题目内容
现有部分短周期元素的性质或原子结构如下表:
(1)写出元素Z的离子结构示意图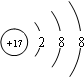
 .Y的最高价氧化物中,化学键Y-O的物质的量与Y的物质的量之比为:
.Y的最高价氧化物中,化学键Y-O的物质的量与Y的物质的量之比为:
(2)X的最高价氧化物与烧碱反应的离子反应方程式为:
(3)Z的非金属性比T元素强,用化学方程式表示:
(4)XT是一种新型的无机材料,可由X的最高价氧化物与T的单质及焦炭反应生成,逸出的气体具有可燃性,写出反应方程式,并标出电子转移方向和数目.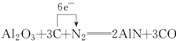
 .
.
| 元素编号 | 元素性质或原子结构 |
| T | 能形成双原子分子,原子间存在3对共用电子对 |
| X | M层有3个电子 |
| Y | 最外层电子数是最内层电子数2倍,其最高氧化物是一种固体,用于生产光导纤维 |
| Z | 最高正价为+7价 |


4
4
(填数字).(2)X的最高价氧化物与烧碱反应的离子反应方程式为:
Al2O3+2OH-+3H2O═2[Al(OH)4]-
Al2O3+2OH-+3H2O═2[Al(OH)4]-
.(3)Z的非金属性比T元素强,用化学方程式表示:
3Cl2+2NH3═N2+6HCl(或3Cl2+8NH3═N2+6NH4Cl)
3Cl2+2NH3═N2+6HCl(或3Cl2+8NH3═N2+6NH4Cl)
.(4)XT是一种新型的无机材料,可由X的最高价氧化物与T的单质及焦炭反应生成,逸出的气体具有可燃性,写出反应方程式,并标出电子转移方向和数目.


分析:先根据元素的原子结构与性质判断T、X、Y、Z四种元素,然后根据各题要求分析解答.
解答:解:由能形成双原子分子,原子间存在3对共用电子对知,T元素最外层5个电子,主族元素的族序数=其最外层电子数,T是氮元素;
由M层有3个电子知,其核外电子排布是2、8、3,故X是铝元素;
由最外层电子数是最内层电子数2倍,其最高氧化物是一种固体,用于生产光导纤维,光导纤维的主要是二氧化硅,所以Y是硅元素;
由最高正价为+7价,主族元素的族序数=其最外层电子数,且是短周期元素,氟没有正化合价,所以是氯元素.
(1)Z是氯元素,最外层7个电子,容易得一个电子达到8电子稳定结构,离子结构示意图为 ,Y形成的最高价氧化物是二氧化硅,硅最外层4个电子,易形成4个共价键,故答案为:
,Y形成的最高价氧化物是二氧化硅,硅最外层4个电子,易形成4个共价键,故答案为: ;4;
;4;
(2)X的最高价氧化物是Al2O3,Al2O3是两性氧化物,既能和强酸反应又能和强碱反应生成盐和水,
故答案为:Al2O3+2OH-+3H2O═2[Al(OH)4]-;
(3)Z的非金属性比T元素强,判断非金属性的方法有:非金属间的置换反应,其最高价氧化物的水化物的酸性强弱,其气态氢化物的稳定性等,
故答案为:3Cl2+2NH3═N2+6HCl(或3Cl2+8NH3═N2+6NH4Cl);
(4)由题意知,XT是AlN,X的最高价氧化物是Al2O3,根据元素守恒知,逸出具有可燃性的气体是CO,碳是还原剂,氮气是氧化剂,故答案为: .
.
由M层有3个电子知,其核外电子排布是2、8、3,故X是铝元素;
由最外层电子数是最内层电子数2倍,其最高氧化物是一种固体,用于生产光导纤维,光导纤维的主要是二氧化硅,所以Y是硅元素;
由最高正价为+7价,主族元素的族序数=其最外层电子数,且是短周期元素,氟没有正化合价,所以是氯元素.
(1)Z是氯元素,最外层7个电子,容易得一个电子达到8电子稳定结构,离子结构示意图为
 ,Y形成的最高价氧化物是二氧化硅,硅最外层4个电子,易形成4个共价键,故答案为:
,Y形成的最高价氧化物是二氧化硅,硅最外层4个电子,易形成4个共价键,故答案为: ;4;
;4;(2)X的最高价氧化物是Al2O3,Al2O3是两性氧化物,既能和强酸反应又能和强碱反应生成盐和水,
故答案为:Al2O3+2OH-+3H2O═2[Al(OH)4]-;
(3)Z的非金属性比T元素强,判断非金属性的方法有:非金属间的置换反应,其最高价氧化物的水化物的酸性强弱,其气态氢化物的稳定性等,
故答案为:3Cl2+2NH3═N2+6HCl(或3Cl2+8NH3═N2+6NH4Cl);
(4)由题意知,XT是AlN,X的最高价氧化物是Al2O3,根据元素守恒知,逸出具有可燃性的气体是CO,碳是还原剂,氮气是氧化剂,故答案为:
 .
.点评:原子的结构决定其性质,性质体现结构;准确推断各元素是解题的关键;Y的最高价氧化物中,求化学键Y-O的物质的量与Y的物质的量之比是本题的难点,硅原子最外层4个电子,需要形成4个共价键,使最外层达8电子稳定结构,所以,一个硅原子周围有4个氧原子,从而得出正确答案.

练习册系列答案
相关题目






 Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-