题目内容
【题目】煤炭燃烧时产生大量SO2、NO对坏境影响极大。
(1)使用清洁能源可有效减少SO2等的排放。煤的液化是现代能源工业中重点推广的能源综合利用方案,最常见的液化方法为用煤生产CH3OH。已知制备甲醇的有关化学反应及平衡常数如下:
i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-90.8kJ/mol
CH3OH(g)+H2O(g) △H1=-90.8kJ/mol
ii:C0(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2kJ/mol
CO2(g)+H2(g) △H2=-41.2kJ/mol
iii:CO(g)+2H2(g)![]() CH3OH(g) △H3
CH3OH(g) △H3
850℃时,三个反应的平衡常数分别为K1=160、K2=243、K3=160。甲醇还可以与乙酸反应制香料,反应为:CH3OH(l)+CH3COOH(l)![]() CH3COOCH3(l)+H2O(l)
CH3COOCH3(l)+H2O(l)
①△H3=_______制香料反应的平衡常数K 的表达式为____________。
②850℃时,在密闭容器中进行反应i,开始时只加入CO2、H2,反应10min后测得各组分的浓度如下表。比较正、逆反应的速率的大小:V正_____V逆 (填“>”、“<”或“=”)。
物质 | H2 | CO2 | CH3OH | H2O |
浓度/mol/L | 0.2 | 0.2 | 0.4 | 0.4 |
(2)研究人员发现,将煤炭在O2/CO2的气氛下燃烧,能够降低然煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2L的恒容密闭容器中充入0.1molNO和0.3molCO发生该反应,如图为容器内的压强(p)与起始压强(p0)的比值(p/p0)随时间的变化曲线。
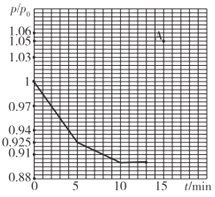
①0~5min内,该反应的平均反应速率V(N2)=______;平衡时NO的转化率为________。
②若13min时,向该容器中再充入0.06molCO,15min时再次达到平衡,此时容器内p/p0的比值应在图中A点的______(填"上方”或“方”)。
(3)以连二硫酸盐(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO),装置如图所示:

①阴极区的电极反应式为_________。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为_______mL。
【答案】 -132.0kJ/mol ![]() > 3×10-3mol/(L·min) 80% 下方 2SO32-+4H++2e-=S2O42-+2H2O 1344
> 3×10-3mol/(L·min) 80% 下方 2SO32-+4H++2e-=S2O42-+2H2O 1344
【解析】(1)①反应ⅲ=反应ⅰ+反应ⅱ,所以△H3=△H1+△H2=-90.8+(-41.2)=-132.0kJ/mol。该反应的平衡常数表达式为K=![]() 。注意这里的水不是溶剂所以应该有浓度,不能视为1。②10min时反应ⅰ的浓度商Q=
。注意这里的水不是溶剂所以应该有浓度,不能视为1。②10min时反应ⅰ的浓度商Q=![]() <K1=160,所以反应正在向正反应方向进行,V正>V逆。
<K1=160,所以反应正在向正反应方向进行,V正>V逆。
(2)①同温同体积下,压强的比等于气体的物质的量的比,5分钟的时候压强是初始压强的0.925倍,所以气体的物质的量是初始物质的量的0.925倍,即5分钟的时候物质的量为(0.1+0.3)×0.925=0.37mol,减少了0.03mol气体。反应为2NO(g)+2CO(g)=N2(g)+2CO2(g),每反应2molNO和2molCO生成1molN2和2molCO2,气体的物质的量会减少1mol,所以可以认为每生成1molN2会减少1mol气体。上面计算出来气体减少了0.03mol,所以生成0.03molN2,则![]() 。达平衡时的压强是初始压强的0.9倍,所以平衡时的总物质的量为(0.1+0.3)×0.9=0.36mol,气体的物质的量一共减少0.04mol,由上所述可以得到:生成0.04molN2,所以反应的NO为0.08mol,其转化率为0.08÷0.1=80%。②根据①中计算的数据,第一次达平衡时,总物质的量为0.36mol,加入0.06molCO,瞬间总物质的量变为0.42mol,此时p/p0=0.42/0.4=1.05(就是A点的纵坐标)。因为加入CO,所以反应的平衡向正反应方向移动,气体的物质的量还会减少,所以p/p0的数值会减小,达到新平衡时,p/p0的数值一定在A点下方。
。达平衡时的压强是初始压强的0.9倍,所以平衡时的总物质的量为(0.1+0.3)×0.9=0.36mol,气体的物质的量一共减少0.04mol,由上所述可以得到:生成0.04molN2,所以反应的NO为0.08mol,其转化率为0.08÷0.1=80%。②根据①中计算的数据,第一次达平衡时,总物质的量为0.36mol,加入0.06molCO,瞬间总物质的量变为0.42mol,此时p/p0=0.42/0.4=1.05(就是A点的纵坐标)。因为加入CO,所以反应的平衡向正反应方向移动,气体的物质的量还会减少,所以p/p0的数值会减小,达到新平衡时,p/p0的数值一定在A点下方。
(3)①阴极应该是将SO32-得电子转化为S2O42-,即将+4价S转化为+3价的S,所以2个SO32-得2个电子转化为1个S2O42-,反应物中再补充氢离子,生成物补充水分子,根据原子个数守恒和电荷守恒配平得到:2SO32-+4H++2e-=S2O42-+2H2O。②NO吸收转化后的主要产物为NH4+,即N的化合价由+2降低为-3,所以1个NO得到5个电子,即NO的物质的量是转移电子的物质的量的1/5,当转移0.3mole-时反应的NO为0.06mol,体积为1344mL。