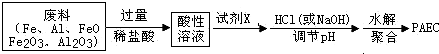
题目内容
14.2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl反应过程中发生了电子的得失:钠元素从0价升高到+1价,一个钠原子失去一个电子,钠元素被氧化
氯元素从0价降低到-1价,一个氯原子得到一个电子,氯元素被还原.
分析 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl中,Na元素的化合价由0升高为+1价,Cl元素的化合价由0降低为-1价,以此来解答.
解答 解:2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl中,钠元素从0价升高到+1价,一个钠原子失去一个电子,钠元素被氧化;氯元素从0价降低到-1价,一个氯原子得到一个电子,氯元素被还原,故答案为:+1;失去;氧化;-1;得到;还原.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
5.某电解质,当把其固体加热时,能生成一种气体和一种新的离子化合物的是( )
| A. | H2SO4 | B. | KClO3 | C. | CaO | D. | NaHCO3 |
19.下列电解质在水中发生电离后得到的阴离子与阳离子的物质的量之比为2:1的是( )
| A. | 氯化钡 | B. | 硫酸铜 | C. | 硝酸钾 | D. | 氯酸钾 |
19. 实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如图:
实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如图:
相关数据如下:
实验步骤:
1.【合成】:在a中加入20.00g纯环己醇及2小块沸石,冷却搅动下缓慢加入1mL浓硫酸.b中通入冷却水后,缓慢加热a,控制馏出物的温度不超过90℃.
2.【提纯】:将反应后粗产物倒入分液漏斗中,依次用少量5% Na2CO3溶液和水洗涤,分离后加入无水CaCl2颗粒,静置一段时间后弃去CaCl2.再进行蒸馏最终获得12.30g纯环己烯.
回答下列问题:
(1)装置b的名称是冷凝管.加入沸石的目的是防暴沸.
(2)本实验中最容易产生的副产物的结构简式为 .
.
(3)分液漏斗在使用前必须清洗干净并检漏.本实验分液所得产物应从上口倒出(填“上口”或“下口”).
(4)提纯过程中加入Na2CO3溶液的目的是除去多余的H2SO4,加入无水CaCl2的作用是干燥所得环己烯.
(5)本实验所得环己烯的产率是75%(产率=$\frac{实际产量}{理论产量}$×100%).
 实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如图:
实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如图:相关数据如下:
| 相对分子数量 | 密度 | 沸点 | 溶解性 | |
| 环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环乙烯 | 82 | 0.8102 | 83 | 难溶于水 |
1.【合成】:在a中加入20.00g纯环己醇及2小块沸石,冷却搅动下缓慢加入1mL浓硫酸.b中通入冷却水后,缓慢加热a,控制馏出物的温度不超过90℃.
2.【提纯】:将反应后粗产物倒入分液漏斗中,依次用少量5% Na2CO3溶液和水洗涤,分离后加入无水CaCl2颗粒,静置一段时间后弃去CaCl2.再进行蒸馏最终获得12.30g纯环己烯.
回答下列问题:
(1)装置b的名称是冷凝管.加入沸石的目的是防暴沸.
(2)本实验中最容易产生的副产物的结构简式为
 .
.(3)分液漏斗在使用前必须清洗干净并检漏.本实验分液所得产物应从上口倒出(填“上口”或“下口”).
(4)提纯过程中加入Na2CO3溶液的目的是除去多余的H2SO4,加入无水CaCl2的作用是干燥所得环己烯.
(5)本实验所得环己烯的产率是75%(产率=$\frac{实际产量}{理论产量}$×100%).
 名称是3,5-二甲基庚烷.
名称是3,5-二甲基庚烷.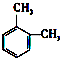 名称是1,2-二甲苯.
名称是1,2-二甲苯.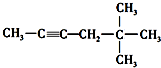 名称是5,5-二甲基-2-己炔.
名称是5,5-二甲基-2-己炔. 名称是4-甲基-1-戊烯.
名称是4-甲基-1-戊烯.