��Ŀ����
����Ŀ���������к���C��H��O��N��S��Ԫ�أ�ʳ���е�����Ҫ���������뵰���ʺ������ϳ���������ʽ���ڡ�
(1)�ڵ��������漰��̼��������Ԫ�ص�һ��������С�����˳����________________����̬��ԭ�ӵļ۵����Ų�ʽΪ____________��
(2)KSCN�Ǽ���Fe3�����Լ�֮һ����SCN����Ϊ�ȵ������һ�ַ���Ϊ________(�ѧʽ)��1 mol CN���к��е���������ĿΪ____________________��
(3)FeCl3�еĻ�ѧ���������ԵĹ����ԣ�����״̬����˫�۷��ӣ������ʽΪFe2Cl6�����ڵĽṹʽΪ________________������Fe����λ��Ϊ____________��
(4)����������Cu2Zn�Ͻ��ܵ��磬�۵�ϸߣ�ǿ�ȡ�Ӳ�Ƚϴ�Cu2Zn�Ͻ�ľ���������_______��
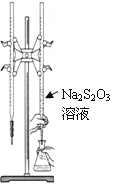
(5)ij��ͭ����������ӽṹ��ͼ��ʾ��
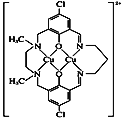
�ٸ������д��ڵ���������_______________��
a.���Ӽ�����b.���ۼ����� c.��λ������d.��� e.���»���
�ڸ�������Nԭ�ӵ��ӻ�������________��
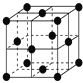
(6)ͭ����Ϊ�����������ܶѻ������ھ���ṹ�п��Էָ��һ����������Ľṹ��Ԫ������ԭ�Ӵ�����������İ˸�������������ϣ���֪ͭ��ԭ�Ӱ뾶Ϊ127.8 pm����ʽ���㾧��ͭ���ܶȣ���=______________g��cm-3(�г�����ʽ����)��
���𰸡�C<O<N 3d64s2 N2O��CO2 2��6.02��1023 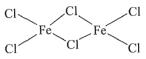 4 �������� bc sp2��sp3�ӻ�
4 �������� bc sp2��sp3�ӻ� 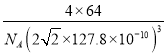
��������
(1)ͬһ���ڵ�����Ԫ�صĵ�һ��������ԭ������������������ƣ�����IIA��VAԪ�صĵ����ܴ�����������Ԫ�أ�����ԭ�Ӻ�������Ų��Ĺ���ԭ����д��̬��ԭ�ӵļ۵����Ų�ʽ;
(2)��SCN-��Ϊ�ȵ����壬Ӧ����3��ԭ�ӣ���������������ͬ�� CN-��N2��Ϊ�ȵ����壻
(3)����״̬����˫�۷��Ӵ��ڵ�FeCl3������Fe-Cl����
(4)Cu2Zn�Ͻ��ܹ����磬˵���þ��������ǽ������壻
(5)����ͼ��֪��ͭ������N��Oԭ��֮���γ���λ�����ǽ���ԭ��֮���γɹ��ۼ���
�������д���C=N˫���е�Nԭ���γ�3������������Nԭ���γ�4����������û�йµ��Ӷԣ�
(6)���ݾ�̯�����㾧����Cuԭ����Ŀ����ʾ�������������ٸ�����=![]() ���㾧���ܶȡ�
���㾧���ܶȡ�
(1)̼��������Ԫ�ض��ǵڶ����ڵ�Ԫ�أ�����ͬһ����Ԫ�صĵ�һ�����ܳ��������ơ���IIAԪ�ش��ڹ����ȫ�����ȶ�״̬��VA��ԭ�Ӻ�����Ӵ��ڰ�������ȶ�״̬�����������ܴ���ͬһ��������Ԫ�أ���������Ԫ�صĵ�һ��������С�����˳����C<O<N��
Feԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p63d64s2��FeΪ����Ԫ�أ���ԭ����������Ϊ�۵����⣬������3d���ӣ��ʼ۵����Ų�ʽΪ3d64s2��
(2)��SCN-��Ϊ�ȵ����壬Ӧ����3��ԭ�ӣ���������������ͬ����ΪCO2��N2O�ȣ� CN-��N2��Ϊ�ȵ����壬���߽ṹ���ƣ���CN-�������γ�C��N������1mol CN-�к��е���������ĿΪ2��6.02��1023��
(3)FeCl3�еĻ�ѧ���������ԵĹ����ԣ�����״̬����˫�۷��Ӵ��ڵ�FeCl3�ĽṹʽΪ ��Feԭ����Χ��4��Cl��������Fe����λ��Ϊ4��
��Feԭ����Χ��4��Cl��������Fe����λ��Ϊ4��
(4)Cu2Zn�Ͻ��ܹ����磬˵���þ��������ǽ������壻
(5)����ͼ��֪��ͭ������N��Oԭ��֮���γ���λ�����ǽ���ԭ��֮���γɹ��ۼ����ʺ���ѡ����bc��
�������д���C=N˫���е�Nԭ���γ�3������������Nԭ���γ�4����������û�йµ��Ӷԣ��ֱ��ȡsp2�ӻ���sp3�ӻ���
(6)����Ϊ���������ܶѻ���������Խ����ϵ�Cuԭ�����ڣ����ⳤΪ127.8pm��4��![]() =
=![]() ��2��127.8pm��������Cuԭ����ĿΪ8��
��2��127.8pm��������Cuԭ����ĿΪ8��![]() +6��
+6��![]() =4������������Ϊm=4��
=4������������Ϊm=4��![]() g�����Ծ������ܶ���=
g�����Ծ������ܶ���=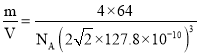 g/cm3��
g/cm3��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ������������ʵ�����������õ���ƽ�ⳣ����ʾ����1�dz����¼�������ĵ���ƽ�ⳣ��(Ka)������ĵ���ƽ�ⳣ��(Kb)����2�dz����¼����ѣ���������ܶȻ�����(Ksp)��
��1
���� | ����ƽ�ⳣ����Ka��Kb�� |
CH3COOH | 1.8��10��5 |
HNO2 | 4.6��10��4 |
HCN | 5��10��10 |
HClO | 3��10��8 |
NH3H2O | 1.8��10��5 |
��2
�ѣ������� | �ܶȻ�������Ksp�� |
BaSO4 | 1��10��10 |
BaCO3 | 2.6��10��9 |
CaSO4 | 7��10��5 |
CaCO3 | 5��10��9 |
��ش��������⣺
��1����1�������������У�������������_____���û�ѧʽ��ʾ����������ʹ������Һ��CH3COOH�ĵ���̶���������ƽ�ⳣ������IJ�����___������ĸ��ţ���
A�������¶� B����ˮϡ��
C����������CH3COONa���� D��������������
��2��CH3COONH4��ˮ��Һ��_____��ѡ����ԡ��������ԡ����ԡ���������Һ�д��ڵĸ�����Ũ�ȴ�С��ϵΪ_____��
��3�����ʵ���֮��Ϊ1��1��NaCN��HCN�Ļ����Һ����pH��7������Һ������Ũ�ȴӴ�С��˳��Ϊ_____��
��4����ҵ�г���BaSO4ת��ΪBaCO3���ٽ����Ƴɿ����Եı��Σ���BaCl2���������������ñ��͵Ĵ�����Һ����BaSO4��ĩ�������ϲ��䴿����BaSO4ת��ΪBaCO3����������BaSO4����Һ���ڸ�����Һ�мӴ����ĩ�����Ͻ��裬ΪʹSO42�����ʵ���Ũ�Ȳ�С��0.01molL��1������Һ��CO32�����ʵ���Ũ������ӦΪ_____��