题目内容
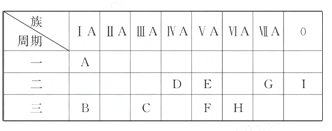
【题目】已知和碳元素同主族的X元素位于周期表中的第1个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们所形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为__________;Y元素原子最外层电子的电子排布图为__________。
(2)若X、Y两元素电负性分别为2.1和2.85,则XY4中X与Y之间的化学键为__________(填“共价键”或“离子键”)。
(3)该化合物的立体构型为__________,中心原子的杂化类型为__________,分子为__________(填“极性分子”或“非极性分子”)。
【答案】(1)1s22s22p63s23p63d104s24p2 ![]()
(2)共价键(3)正四面体形 sp3杂化 非极性分子
【解析】X位于第四周期第ⅣA族,为锗(Ge)元素。若Y为第二周期元素,第二周期元素只有两个电子层,则内层电子数为2,不符合题意;若Y为第三周期元素,由题意知为氯元素,电子排布式为1s22s22p63s23p5。
(1)由构造原理写出32Ge、17Cl的电子排布式、电子排布图。
(2)Ge、Cl两元素的电负性差值小,两者形成共价键。
(3)GeCl4中Ge原子中无孤电子对,故GeCl4为正四面体形分子,Ge原子采取sp3杂化。

练习册系列答案
相关题目