题目内容
【题目】电导率可用于衡量电解质溶液导电能力大小。室温下,用0.100 mol·L-1 NH3·H2O溶液滴定10.00 mL浓度均为0.100 mol·L-1盐酸和CH3COOH溶液的混合溶液,所得曲线如图所示。下列说法正确的是
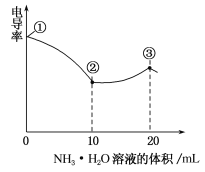
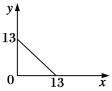
A.①点溶液中c(H+)为0.200 mol·L-1
B.溶液温度高低为①>③>②
C.③点溶液中有c(Cl-)>c(CH3COO-)
D.③点后因离子数目减少使溶液电导率略降低
【答案】C
【解析】①点尚未开始滴定,由于CH3COOH是弱酸,存在电离平衡,此时c(H+)<0.200 mol·L-1,A项错;由于中和反应为放热反应,随着反应进行溶液温度升高,B项错;③点时加入20 mL NH3·H2O溶液恰好把HCl、CH3COOH完全中和,生成等物质的量的NH4Cl与CH3COONH4,由于CH3COO-发生水解,导致c(Cl-)>c(CH3COO-),C项正确;③点后,继续滴加氨水,中和反应已进行完全,溶液体积增大造成离子浓度降低,导致电导率降低,D项错。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】阅读图表材料,回答下列问题。
2003年北京市与河南省人口增长指标(%)
自然增长率 | 总增长率 | |
北京市 | 0.015 | 5.292 |
河南省 | 0.564 | 0.562 |
(1)材料反映的北京市人口增长模式为__________________。北京市的人口总增长率比自然增长率高,其原因是________________________________________________________________。
(2)河南省的人口总增长率比自然增长率低,主要由于___________________________________引起的。
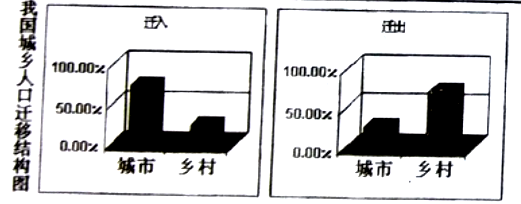
(3)结合我国城乡人口迁移结构图,简述河南省人口迁移的方向及其原因。
方向:________________________________________________________________________________。
原因:________________________________________________________________________________。