题目内容
【题目】某温度(t ℃)下的溶液中,c(H+)=1.0×10x mol·L1,c(OH)=1.0×10y mol·L1,x与y的关系如图所示。请回答下列问题:
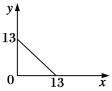
(1)该温度下,水的离子积常数KW为________,则t ℃________25 ℃(填“>”、“<”或“=”)。
(2)将此温度(t ℃)下a L 0.01 mol·L1的苛性钠溶液与b L 0.05 mol·L1的稀硫酸混合(混合后溶液的体积变化忽略不计)。
①若所得溶液呈中性,则a︰b=___________;所得溶液中各种离子的浓度由大到小的顺序是____________________。
②若所得溶液中c(H+)=0.01 mol·L1,则a︰b=___________;所得溶液中各种离子的浓度由大到小的顺序是_______________________。
【答案】(12分,每空2分)
(1)1.0×1013 >
(2)①10︰1 c(Na+)>c(![]() )>c(H+)=c(OH)
)>c(H+)=c(OH)
②9︰2 c(H+)>c(![]() )>c(Na+)>c(OH)
)>c(Na+)>c(OH)
【解析】(1)由图可知,y=13时,x=0,则KW=c(H+)·c(OH)=1.0×100×1.0×1013=1.0×1013。该温度下水的离子积常数大于25 ℃时水的离子积常数,故t ℃高于25 ℃。
(2)①所得溶液呈中性,则n(OH)=n(H+),即0.01a=0.1b,a︰b=10︰1。所得溶液的溶质是Na2SO4。②所得溶液中c(H+)=0.01 mol·L1,则说明稀硫酸过量,故(0.1b0.01a)/(a+b)=0.01,即a︰b=9︰2。所得溶液中的溶质是Na2SO4和H2SO4,且二者的物质的量之比为9︰11,因此所得溶液中c(H+)>c(![]() )>c(Na+)>c(OH)。
)>c(Na+)>c(OH)。