题目内容
【题目】W、R、X、Y、Z是元素周期表前四周期中原子序数依次增大的常见元素,其相关信息如下表:
元素 | 相关信息 |
W | W的一种单质是自然界硬度最大的晶体 |
X | X基态原子L层中p轨道电子数是s轨道电子数的2倍 |
Y | Y所在主族序数与所在周期序数之差为4,同周期主族元素中原子半径最小 |
Z | Z位于元素周期表第Ⅷ族,最高能级的原子轨道内只有2个未成对电子 |
回答下列问题:
(1)Z基态原子的价层电子排布式为__________________。第三周期基态原子未成对电子数与Z相同且电负性最大的元素名称为____________。
(2)W在形成化合物时,其键型以共价键为主,原因是 。HYX4的酸性强于HYX3,原因是______。
(3)R和Y可组成原子个数比为1∶3的化合物M,M的立体构型为 ,中心原子的杂化轨道类型为 。
(4)Z(WX)n的中心原子价电子数与配体提供电子总数之和为18,则n=________。根据等电子原理,W、X分子内σ键与π键的个数之比为______________。
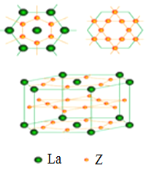
(5)镧和Z形成的合金有很强的储氢能力,其晶胞结构如图。已知该合金为LaZx,晶胞体积为9.0×10-23cm3,储氢后形成LaZxH4.5的合金(氢进入晶胞空隙,体积不变),则LaZx中x=_____(填数值);氢在合金中的密度为_______gcm-3(精确到0.01)。
【答案】(1)3d84s2 硫
(2)C有4个价电子且半径较小,难以通过得或失电子达到稳定电子结构 HClO4分子中Cl的价态比HClO3中更高,导致Cl-O-H中O的电子向Cl偏移得更多,在水分子的作用下,就更容易电离出H+,故酸性更强
(3)三角锥形 sp3
(4)4 1∶2
(5)5 0.25
【解析】W的一种单质是自然界硬度最大的晶体,则W是C;X基态原子L层p轨道电子数是s轨道电子数的2倍,则X是O元素,所以R是N;Y所在主族序数与所在周期序数之差为4,同周期主族元素中原子半径最小,则Y是Cl元素;Z位于第四周期第Ⅷ族,最高能级的原子轨道内只有2个未成对电子,且原子序数比Y大,即Z为Ni。
(1)Ni属于过渡元素,价电子包括最外层电子和次外层d能级上的电子,即价电子排布式为3d84s2;第三周期基态原子未成对电子数有2个的是硅、硫,同周期从左向右电负性增大,即电负性最大的是硫;
(2)在原子结构中,最外层电子小于4个的原子易失去电子,而C原子的最外层是4个电子,且C原子的半径较小,则难以通过得或失电子达到稳定结构,所以主要通过共用电子对即形成共价键的方式来达到稳定结构;HClO4分子中Cl的价态比HClO3中更高,导致Cl-O-H中O的电子向Cl偏移得更多,在水分子的作用下,就更容易电离出H+,故酸性更强;
(3)R和Y可组成原子个数比为1∶3的化合物M,即M是NCl3,其中N含有一对孤对电子,其价层电子对数是4,所以M的立体构型为三角锥形,中心原子的杂化轨道类型为sp3。
(4)此化合物是Ni(CO)n,中心原子价电子数为10,配体是CO,提供2个电子,即10+2n=18,解得n=4,CO和N2互为等电子体,N2分子内N和N原子之间为氮氮叁键,即σ键与π键个数比为1∶2;
(5)由图可知,晶胞中La原子数目为2×1/2+12×1/6=3,Ni原子数目为6+18×1/2=15,储氢后形成LaNixH4.5的合金(氢进入晶胞空隙,体积不变),故1∶x=3∶15,则x=5;晶胞中H原子数目为4.5×3=13.5,晶胞体积为9.0×10-23cm3,氢在合金中的密度为![]() 。
。