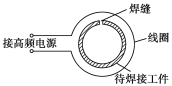
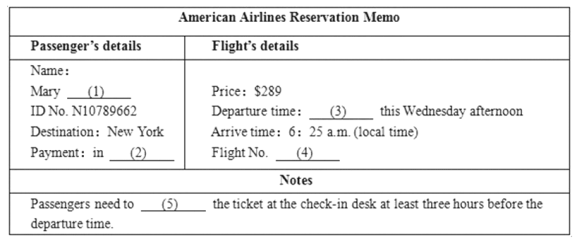
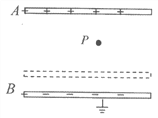
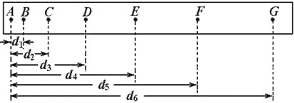
题目内容
【题目】已知室温时,0.1 mol·L-1的某一元酸HA在水中有0.1%发生电离,回答下列各问题:
(1)HA的电离平衡常数K=_____________。
(2)升高温度时,K将_____________(填“增大”、“减小”或“不变”)。(3)由HA电离出的c(H+)约为水电离出的c(H+)的_____________倍。
【答案】(1)1×10-7(2)增大(3)106
【解析】(1)HA电离出的c(H+)=(0.1×0.1%) mol·L-1=1×10-4 mol·L-1;
(2)电离平衡常数K=![]() =
=![]() =1×10-7;
=1×10-7;
(3)因HA![]() H++A-,电离过程是吸热的,所以升高温度,c(H+)、c(A-)均增大,则K增大;
H++A-,电离过程是吸热的,所以升高温度,c(H+)、c(A-)均增大,则K增大;
(4)c(H+)HA=1×10-4 mol·L-1,c(H+)水=c(OH-)=![]() mol·L-1=1×10-10 mol·L-1,所以c(H+)HA∶c(H+)水=(1×10-4)∶(1×10-10)=106。
mol·L-1=1×10-10 mol·L-1,所以c(H+)HA∶c(H+)水=(1×10-4)∶(1×10-10)=106。

练习册系列答案
相关题目