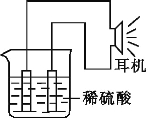
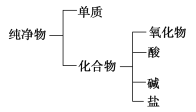
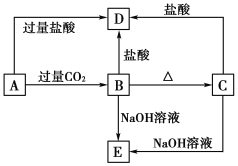
题目内容
【题目】已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4![]() 2AsH3↑+6ZnSO4+3H2O。
2AsH3↑+6ZnSO4+3H2O。
(1)请用双线桥法标出电子转移的方向和数目____________________________________。
(2)As2O3在上述反应中显示出来的性质是____________(填序号)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为___________。
【答案】(1) 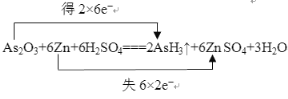
(2)A
(3)ZnSO4 AsH3
(4)1.2NA
【解析】(1)在As2O3+6Zn+6H2SO4![]() 2AsH3↑+6ZnSO4+3H2O中,As的化合价由+3降为3,共得到6×2=12个电子,Zn的化合价由0升高为+2,共失去2×6=12个电子。
2AsH3↑+6ZnSO4+3H2O中,As的化合价由+3降为3,共得到6×2=12个电子,Zn的化合价由0升高为+2,共失去2×6=12个电子。
(2)As2O3中As元素的化合价降低,发生还原反应,作氧化剂,所以表现为氧化性。
(3)该反应中Zn被氧化,氧化产物是ZnSO4,As被还原,还原产物是AsH3。
(4)由双线桥可知,生成2 mol AsH3,转移电子12 mol,若生成0.2 mol AsH3,则转移电子的物质的量是1.2 mol,电子数是1.2NA。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目