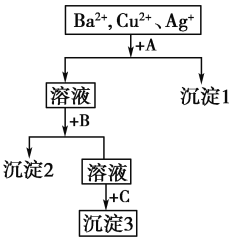
题目内容
【题目】HIO4主要以H5IO6形式存在,H5IO6是白色晶体,易溶于水,具有很强的氧化性,在强酸溶液中能氧化Mn2+。
(1)请完成并配平下列离子反应。
__________Mn2++________H5IO6![]() __________
__________![]() +________
+________![]() +________H++________
+________H++________
(2)根据以上离子方程式判断H5IO6是________电离物质(填“易”或“难”)。
(3)上述反应,被氧化的元素是________(填元素符号),当1 mol Mn2+参加反应时,转移电子的物质的量为________。
【答案】(1)2 5 2 5 11 7H2O
(2)难
(3)Mn 5 mol
【解析】Mn2+―→![]() ~5e,H5IO6―→
~5e,H5IO6―→![]() ~2e,根据电子守恒,Mn2+、
~2e,根据电子守恒,Mn2+、![]() 化学计量数均为2,H5IO6、
化学计量数均为2,H5IO6、![]() 化学计量数均为5,根据O原子守恒,生成物中补加7H2O,根据H原子守恒,H+化学计量数为11。在离子方程式中,易溶物质H5IO6写成化学式,只能是难电离的弱电解质。
化学计量数均为5,根据O原子守恒,生成物中补加7H2O,根据H原子守恒,H+化学计量数为11。在离子方程式中,易溶物质H5IO6写成化学式,只能是难电离的弱电解质。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目