题目内容
【题目】电石中的CaC2与H2O反应可用于制C2H2:CaC2+2H2O→C2H2↑+Ca(OH)2。通过排水测量出反应产生的气体的体积,从而可测定电石中碳化钙的含量。
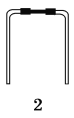
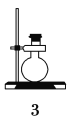
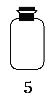
(1)若使用下列仪器和导管组装实验装置,如下所示:
仪器和 导管 |
|
|
|
仪器和 导管 |
|
|
|
每个橡皮塞都打了两个孔 | |||
如果所制气体从左向右通过时,上述仪器和导管从左到右直接连接的顺序是(填仪器与导管的序号):
________接________接________接________接________接________。
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞。
②检查装置的气密性。
③在仪器6和5中注入适量水。
④待仪器3恢复到室温时,量取仪器4中水的体积(导管2中水忽略不计)。
⑤慢慢开启仪器6的活塞,使水逐滴滴下至不产生气体为止,关闭活塞。
正确的操作顺序是(用操作编号填空)________。
(3)若实验产生的气体有难闻的气味,且测定结果偏大,这是因为电石中含有________杂质。
(4)若实验时称取电石为1.60 g,测量出排水的体积后,折算成标准状况下乙炔的体积为448 mL,求此电石中碳化钙的质量分数。
【答案】(1)6 3 1 5 2 4
(2)②①③⑤④
(3)其他可与水反应的 (4)80.0%
【解析】要正确排出仪器连接顺序,应首先搞清实验原理。气体发生装置应选6和3。排出的水用量筒接收,所以量筒放最后。5中盛满水用于排水测量气体体积,所以进气管应短,排水管应长,因此导管1用于连接3和5,导管2用于连接5和4。

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目