题目内容
【题目】某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验。

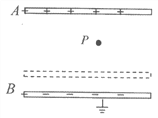
(1)根据图A写出实验室制取氨气的化学方程式 ;
(2)棉花的作用是什么? ;
(4)甲同学用干燥的圆底烧瓶收集一瓶氨气,
(3)如何检验氨气已收集满? ;
根据图B进行实验,观察到的现象是 ;根据实验现象说明氨气具有的性质是 ;
(5)乙同学和丙同学重复甲同学所做实验,圆底烧瓶中所得溶液如图C所示。请通过分析确认:乙同学所得氨水的物质的量浓度___________(填“大于”、“小于”或“等于”)丙同学所得氨水的物质的量浓度。
【答案】(1)2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O(2)减缓氨气与空气的对流,使收集到的氨气更纯(3)将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则说明氨气已集满;(或用玻璃棒蘸取浓盐酸,靠近试管口,若产生白烟,则说明氨气已集满)(4)形成红色喷泉;氨气极易溶于水,氨气与水反应生成碱(5)等于
CaCl2+2NH3↑+2H2O(2)减缓氨气与空气的对流,使收集到的氨气更纯(3)将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则说明氨气已集满;(或用玻璃棒蘸取浓盐酸,靠近试管口,若产生白烟,则说明氨气已集满)(4)形成红色喷泉;氨气极易溶于水,氨气与水反应生成碱(5)等于
【解析】(2)收集气体的管口的棉花可以减缓氨气与空气的对流,使收集到的氨气更纯;
(3)氨气的水溶液显碱性,检验氨气已收集满可以将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则说明氨气已集满,故答案为:将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则说明氨气已集满;(或用玻璃棒蘸取浓盐酸,靠近试管口,若产生白烟,则说明氨气已集满)
(4)氨气极易溶于水,且氨气的水溶液显碱性,根据图B进行实验,可以观察到红色喷泉,(5)溶液的体积等于溶解氨气的体积,物质的量浓度都等于 =
=![]() mol/L,与收集的氨气的多少无关,因此乙同学所得氨水的物质的量浓度等于丙同学所得氨水的物质的量浓度。
mol/L,与收集的氨气的多少无关,因此乙同学所得氨水的物质的量浓度等于丙同学所得氨水的物质的量浓度。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案【题目】某课外活动小组准备用如图所示的装置进行实验。现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:
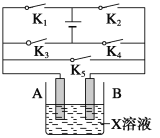
A电极 | B电极 | X溶液 | |
甲 | Cu | Zn | H2SO4 |
乙 | Pt | Pt | CuCl2 |
丙 | Fe | Cu | ? |
(1)甲同学在实验中将电键K5闭合,Zn电极上的电极反应式为________________;
(2)乙同学准备进行电解CuCl2溶液的实验,则电解时的总反应方程式为____________________;
实验时应闭合的电键组合是________。(从下列五项中选择所有可能组合,第三小题也在这五项中选择)
A.K1和K2
B.K1和K3
C.K1和K4
D.K2和K3
E.K2和K4
(3)丙同学准备在Fe上镀Cu,选择了某种盐来配制电镀液,则该盐的化学式为______________,实验时,应闭合的电键组合是___________(选项如上)。