题目内容
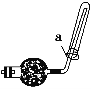
【题目】工业纯碱中常含有NaCl、Na2SO4等杂质,可用如下图所示的装置测定工业纯碱中有效成分的含量。
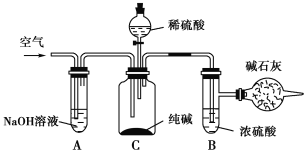
实验过程的主要步骤是:
①准确称取干燥试样x g(x>2),放入广口瓶C中。
②准确称量装有碱石灰的干燥管的质量为y g。
③从分液漏斗中缓缓注入稀硫酸,至不再产生气体为止。
④缓缓鼓入空气数分钟,然后将干燥管取下,准确称量其质量为W g。
根据以上实验,填写下列空格:
(1)装置A的作用是____________________________,如果不用装置A,会导致实验结果偏________(填“大”“小”或“不变”,下同)。
(2)装置B的作用是__________________,如果不用装置B,会导致实验结果偏________。
(3)通入空气的作用是__________________________________________。如果不通入空气,会导致实验结果偏________。
【答案】(1)除去空气中的CO2 大
(2)吸收水分,干燥CO2 大
(3)使广口瓶中由Na2CO3与H2SO4反应产生的CO2排出 小
【解析】本实验涉及的原理是利用H2SO4与Na2CO3反应产生CO2,并通过测定产生CO2的量计算Na2CO3的含量。由于空气中含有少量CO2,所以应在反应产生CO2之前用NaOH溶液除掉空气中的CO2。并且实验过程中产生H2O也会对CO2的测定造成干扰,所以也需要将其用浓硫酸吸收掉,以免造成实验误差。

练习册系列答案
相关题目