题目内容
【题目】298 K时,分别向体积、浓度均为20 mL 0.1 mol·L1的HX溶液、HY溶液中滴加等浓度的NaOH 溶液,混合溶液的pH与加入NaOH溶液体积(V)之间的关系如图所示。(注明:弱电解质的电离度等于已电离的电解质的量与电解质总量之比)下列说法正确的是
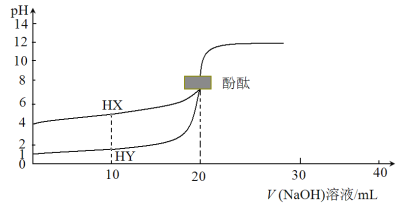
A.298K 时,0.1 mol·L1 HX 溶液中HX的电离度为1%
B.V=10 mL时,同时微热溶液(忽略体积变化),![]() 逐渐增大
逐渐增大
C.V=20 mL 时,HX曲线对应的溶液中c(Na+)=c(X)>c(H+)=c(OH)
D.滴定这两种溶液时都可以选择甲基橙替代酚酞作指示剂
【答案】B
【解析】本题考查弱电解质的电离平衡。A.298 K时浓度为0.1 mol·L1的HX溶液pH=4,c(H+)=104 mol/L,HX的电离度为![]() =0.1%,不正确;B.298 K时浓度为0.1 mol·L1的HY溶液pH=1,说明HY是强酸,V=10 mL时,分别得到等浓度的NaX和HX、NaY和HY,X水解、HX的电离随温度升高而增大,Y不水解、HY完全电离,微热溶液,c(X)增大,c(Y)不变,
=0.1%,不正确;B.298 K时浓度为0.1 mol·L1的HY溶液pH=1,说明HY是强酸,V=10 mL时,分别得到等浓度的NaX和HX、NaY和HY,X水解、HX的电离随温度升高而增大,Y不水解、HY完全电离,微热溶液,c(X)增大,c(Y)不变,![]() 逐渐增大,正确;C.V=20 mL时,HX曲线对应的溶液是NaX,X水解使溶液呈碱性,c(Na+)>c(X)> c(OH)> c(H+),错误;D.甲基橙变色范围 pH3.1~4.4 由红色变为黄色, HX曲线滴定终点时溶液呈碱性,pH>7,误差较大,错误。故选B。
逐渐增大,正确;C.V=20 mL时,HX曲线对应的溶液是NaX,X水解使溶液呈碱性,c(Na+)>c(X)> c(OH)> c(H+),错误;D.甲基橙变色范围 pH3.1~4.4 由红色变为黄色, HX曲线滴定终点时溶液呈碱性,pH>7,误差较大,错误。故选B。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目