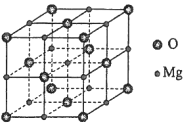
题目内容
【题目】下列四种溶液中,室温下由水电离生成的H+浓度之比(①∶②∶③∶④)是
①pH=0的盐酸 ②0.1 mol·L1的盐酸
③0.01 mol·L1的NaOH溶液 ④pH=11的NaOH溶液
A.1∶10∶100∶1000 B.0∶1∶12∶11
C.14∶13∶12∶11 D.14∶13∶2∶3
【答案】A
【解析】本题主要考查水的电离。酸的溶液中,氢氧根离子是水电离出的,碱的溶液中氢离子是水电离出的,①pH=0的盐酸,溶液中氢离子浓度为1 mol/L,水电离出的氢氧根离子为:![]() mol/L=1×1014 mol/L;②0.1 mol/L盐酸,溶液中氢离子浓度为0.1 mol/L,水电离出的氢氧根离子为:
mol/L=1×1014 mol/L;②0.1 mol/L盐酸,溶液中氢离子浓度为0.1 mol/L,水电离出的氢氧根离子为:![]() mol/L=1×1013 mol/L;③0.01 mol/L的NaOH 溶液,溶液中氢离子浓度为:
mol/L=1×1013 mol/L;③0.01 mol/L的NaOH 溶液,溶液中氢离子浓度为:![]() mol/L=1×1012 mol/L;④pH=11的NaOH溶液,溶液中氢离子浓度为:1×1011 mol/L;所以由水电离H+浓度之比,①∶②∶③∶④=1×1014 mol/L∶1×1013 mol/L∶1×1012 mol/L∶1×1011 mol/L=1∶10∶100∶1000,故选A。
mol/L=1×1012 mol/L;④pH=11的NaOH溶液,溶液中氢离子浓度为:1×1011 mol/L;所以由水电离H+浓度之比,①∶②∶③∶④=1×1014 mol/L∶1×1013 mol/L∶1×1012 mol/L∶1×1011 mol/L=1∶10∶100∶1000,故选A。

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目