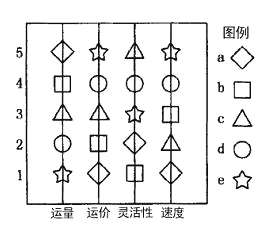
题目内容
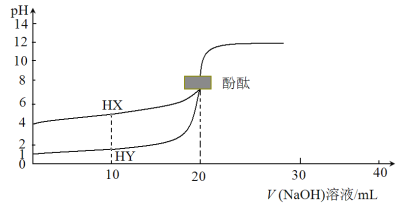
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是
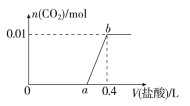
A.在0~a范围内,只发生中和反应
B.ab段发生反应的离子方程式为![]() +2H+
+2H+![]() CO2↑+H2O
CO2↑+H2O
C.a=0.3
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
【答案】C
【解析】本题考查了钠的化合物与盐酸的反应及有关计算。向NaOH和Na2CO3混合溶液中滴加盐酸时,首先盐酸和NaOH反应生成水和氯化钠,NaOH+HCl ![]() NaCl+H2O,继续滴加时,盐酸和Na2CO3开始反应,首先发生HCl+Na2CO3
NaCl+H2O,继续滴加时,盐酸和Na2CO3开始反应,首先发生HCl+Na2CO3 ![]() NaHCO3+NaCl,不放出气体,继续滴加时,发生反应:NaHCO3+HCl
NaHCO3+NaCl,不放出气体,继续滴加时,发生反应:NaHCO3+HCl ![]() NaCl+H2O+CO2↑,此时开始放出气体,故A错。ab段发生反应为:NaHCO3+HCl
NaCl+H2O+CO2↑,此时开始放出气体,故A错。ab段发生反应为:NaHCO3+HCl ![]() NaCl+H2O+CO2↑,反应的离子方程式为:
NaCl+H2O+CO2↑,反应的离子方程式为:![]() +H+
+H+ ![]() H2O+CO2↑,故B错。根据碳元素守恒,混合物中,碳酸钠的物质的量是0.01 mol,所以两步反应:HCl+Na2CO3
H2O+CO2↑,故B错。根据碳元素守恒,混合物中,碳酸钠的物质的量是0.01 mol,所以两步反应:HCl+Na2CO3 ![]() NaHCO3+NaCl,NaHCO3+HCl
NaHCO3+NaCl,NaHCO3+HCl ![]() NaCl+H2O+CO2↑,分别消耗的盐酸的量是0.01 mol,0.1 molL1稀盐酸的体积分别是0.1 L,所以a=0.3,故C正确。a=0.3,碳酸钠转化为碳酸氢钠消耗的盐酸的体积为0.1 L,则氢氧化钠消耗的盐酸的体积为0.2 L,所以原混合溶液中NaOH与Na2CO3的物质的量分别是0.02 mol和0.01 mol,物质的量之比为2∶1,故D错。
NaCl+H2O+CO2↑,分别消耗的盐酸的量是0.01 mol,0.1 molL1稀盐酸的体积分别是0.1 L,所以a=0.3,故C正确。a=0.3,碳酸钠转化为碳酸氢钠消耗的盐酸的体积为0.1 L,则氢氧化钠消耗的盐酸的体积为0.2 L,所以原混合溶液中NaOH与Na2CO3的物质的量分别是0.02 mol和0.01 mol,物质的量之比为2∶1,故D错。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目