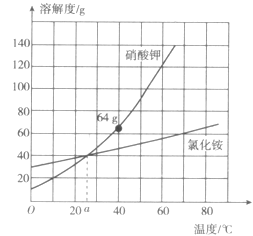
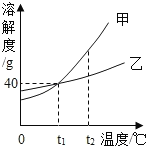
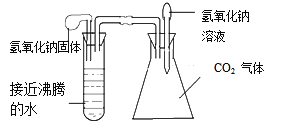
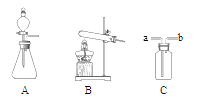
【题目】某同学为测定黄铜屑(由锌和铜形成的合金)样品组。分四次取样品与稀盐酸反应,其实验数据记录见下表。
1 | 2 | 3 | 4 | |
取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
试计算:
①第几次实验金属锌完全反应________。
②所用稀硫酸中溶质的质量分数_______?
【题目】小明在实验室发现一瓶未知浓度的氢氧化钠溶液,为方便以后使用,他对其浓度进行了测定。取20g此氢氧化钠溶液于烧杯中,逐滴滴加溶质质量分数为9.8%的稀硫酸,并随时对反应后的溶液用pH计(一种测定溶液pH的仪器)测定溶液的pH,所得数据如下表:
加入稀硫酸的质量/g | 9.6 | 9.8 | 9.9 | 10 | 10.1 |
溶液的pH | 12.4 | 12.1 | 11.8 | 7 | 2.2 |
(1)当滴加稀硫酸的质量为9.8g时,溶液中的溶质有__________;
(2)计算所测氢氧化钠溶液中溶质的质量分数_________。
【题目】某化学学习小组的同学对一瓶敞口放置一段时间的氢氧化钙固体的化学成分产生了兴趣,他们根据自己所学知识进行如下探究:
[提出问题]该氢氧化钙固体的化学成分是什么?
[猜想假设]
猜想一:Ca(OH)2 猜想二:Ca(OH)2和CaCO3 猜想三:_____________
[实验验证]
实验操作 | 实验现象 | 实验结论 |
(1)取样,向样品中滴加少量酚酞溶液 | _____________ | 猜想二正确 |
(2)取样,加入少量硝酸铵,混合后研磨 | 有氨味放出 | |
(3)取样,向样品中滴加稀盐酸 | _____________ |
请写出操作2中发生反应的化学方程式___________。
[反思交流]
氢氧化钙在空气中变质的化学方程式为_________,因此氢氧化钙必须密封保存
[拓展提升]要想探究反应后物质的成分,除了生成物以外,还应考虑_________。