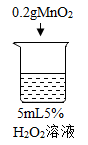
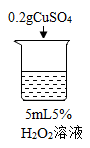
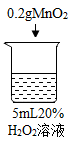
【题目】为探究过氧化氢的分解反应,同学们进行了以下实验。
(查阅资料)过氧化氢分解放热。当氧气低于一定浓度时,可燃物无法燃烧。
(进行实验)
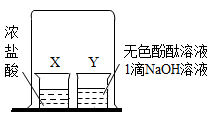
初步探究:探究影响过氧化氢分解速率的因素
序号 | 烧杯1 | 烧杯2 | 烧杯3 | 烧杯4 |
实验操作 |
|
|
|
|
实验现象 | 立即冒大量气泡,烧杯内有 少量白雾出现。 | 5分钟后,有比较大量的气泡冒出。 | 立即冒大量气泡,烧杯内有白雾。 | 立即冒大量气泡,烧杯内有大量白雾。 |
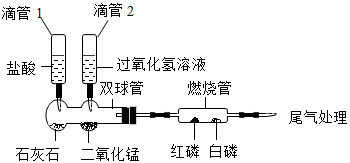
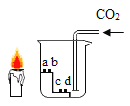
继续探究:重复烧杯1、3、4实验,并分别伸入带火星木条,如下图所示。
实验方案 | 序号 | 实验现象 |
| 烧杯1 | 木条复燃,燃烧很旺 |
烧杯3 | 木条复燃,之后火焰变微弱 | |
烧杯4 | 木条复燃,之后立即熄灭 |
(结论与解释)
(2)为证明MnO2和CuSO4能加快过氧化氢的分解速率,应增加的对比实验是_______(填具体操作)。
(3)能证明过氧化氢溶液浓度影响其分解速率的实验是_____(填烧杯的数字序号)。
(4)烧杯内出现大量白雾的原因是_______。
(反思与评价)
(5)烧杯4中木条熄灭的原因可能是_______。
(6)实验室若用双氧水制取氧气来完成木炭燃烧的实验,应选择的试剂是_______(填字母序号)。
A5%过氧化氢溶液 B10%过氧化氢溶液
C20%过氧化氢溶液 D二氧化锰
【题目】请从 A 或B 两题中任选一个作答,若两题均作答,按 A 计分。
在一定条件下,Mg 和 MgH2的相互转化可以实现氢气的储存和释放。其工作原理如图。
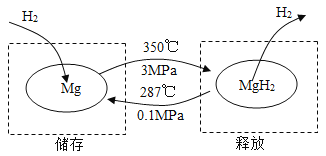
A | B |
(1)氢气储存时发生反应的化学方程式为_______。 (2)氢气很容易逃逸,若氢气存储效率为 10%,储存 1 kg 氢气,至少需要 Mg 的质量为_______ kg。 | (1)氢气释放时发生反应的化学方程式 为_______。 (2)理论上,52 kg MgH2最多能释放氢气的质量为_______ kg。 |
【题目】阅读下面科普短文。
酸奶营养丰富,富含人体生长发育所必须的多种营养物质,是人们喜爱的食品。
表 1 某品牌酸奶中主要营养成分的含量(每 100 克)
蛋白质/克 | 糖类/克 | 脂肪/克 | 钠/毫克 | 钙/毫克 |
2.7 | 9.5 | 2.7 | 75 | 90 |
但是,普通酸奶含有乳糖,经调查,我国有 88.9%的成人缺乏分解乳糖的乳糖酶,有55.1%的成年人表现有乳糖不耐受症状(主要症状为腹泻)。因此,在保证普通酸奶基本营养不损失的前提下,乳糖含量较低或无乳糖的酸奶成为乳糖不耐受消费者的需求。相关科研技术人员为满足消费者的需求,开始研发无乳糖酸奶。无乳糖酸奶的工艺流程为:原料乳 → 标准化 → 添加 6%的白砂糖 → 均质 → 巴氏杀菌 → 冷却→接种发酵剂(直投式发酵剂)→ 发酵(37℃、42℃)→ 4℃低温储存。
研究一 发酵酸奶中添加乳糖酶对乳糖水解效果的影响
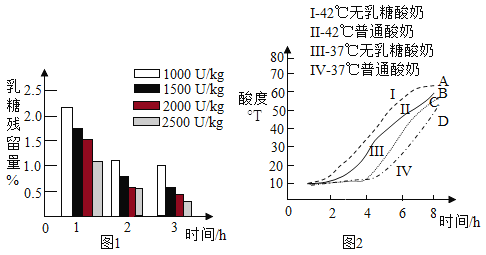
在 37℃,向普通酸奶中添加不同剂量乳糖酶(剂量分别为 1000U/kg、1500U/kg、2000U/kg、2500U/kg),发酵 3 小时,测得发酵酸奶中乳糖残留量随时间的变化,如图 1 所示。
研究二 普通酸奶和无乳糖酸奶发酵过程中的酸度变化
普通酸奶和无乳糖酸奶分别在 37℃和 42℃发酵 8 小时,发酵过程中酸度(从 1 小时开始测量)变化如图 2 所示。
除以上研究,科技人员还在口味、活菌数、保存等方面做了无乳糖酸奶与普通酸奶的对比研究,发现无乳糖酸奶都具有一定的优势。
依据文章内容回答下列问题。
(1)由表 1 可知酸奶的主要营养成分中含量最高的是_______。
(2)由图 1 可知:3 小时内,_______(填字母序号,下同)。
A添加相同量乳糖酶,发酵酸奶中乳糖残留量随时间的延长而降低
B相同发酵时间,乳糖残留量均随乳糖酶添加量的增大而降低
C乳糖残留量与温度、时间、乳糖酶添加量有关
(3)由图 2,影响无乳糖酸奶酸度的因素是_______。
(4)由图 2 可知:42℃时无乳糖酸奶发酵过程中酸度与时间的关系是_______。
(5)下列说法正确的是_______。
A我国绝大部分成年人都有乳糖不耐受症状
B表 1 中“钠”指的是钠元素
C无乳糖酸奶的工艺中至少两步属于化学变化
D无乳糖酸奶比普通酸奶适合更多消费者食用
【题目】随着社会的发展,空气质量对人们身体健康和生活质量具有重要意义。汽车尾气中含有大量的一氧化氮,造成空气污染。SCR 技术利用车用尿素,在一定温度下分解生成的氨气(NH3),对尾气中的一氧化氮进行处理。
储存温度/℃ | 车用尿素保质期/月 |
≤10 | 36 |
11~25 | 18 |
26~30 | 12 |
31~35 | 6 |
(1)其核心反应原理为氨气和一氧化氮在300℃~500℃和催化剂条件下生成氮气和水, 降低污染物的排放。该反应的化学方程式 为_________。
(2)车用尿素溶液保存时间如表所示,据此推测车用尿素具有的性质是_________。
【题目】已知 KNO3的溶解度如下表所示,下列说法不正确的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
溶解度/g | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
A.在 10℃-70℃之间,随着温度的升高,KNO3的溶解度增大
B.20℃时,向 100 g 水中加入 35 g KNO3,充分搅拌,所得溶液质量为 131.6 g
C.将 70℃时不饱和的 KNO3溶液降低温度,有可能转化为饱和溶液
D.50℃时,饱和 KNO3溶液中溶质的质量分数为 85.5%