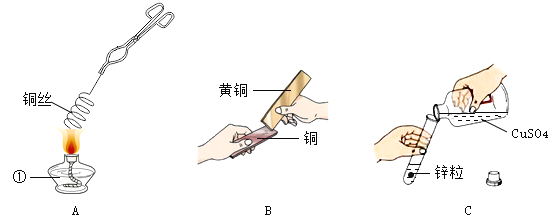
【题目】实验室常用二氧化锰作过氧化氢分解制氧气的催化剂。

[提出问题]催化剂的用量对反应速率是否有影响?
[设计实验](1)实验装置如图所示。
(2)实验记录:每次用30mL10%的过氧化氢溶液,采用不同量的二氧化锰粉末作催化剂进行实验,测定相关数据记录于下表中:
实验序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二氧化锰用量/g | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
待测数据 |
[分析](1)上述实验应该测定的“待测数据”可能是________________;装置中原有的空气对实验是否有干扰?____________,试说明原因:___________________________。
(2)若第2次实验比第3次实验的“待测数据”更_____________(选填“大”或“小”),说明催化剂的用量越多,反应越快。
[实验与结果]经多次实验证明,第1次实验至第7次实验中过氧化氢的分解速率依次加快,第7次实验至第10次实验所记录的“待测数据”无明显差异。
[结论]_________________________。
[拓展](1)实验后对二氧化锰进行回收、称量,发现其质量与反应前相比____________(选填“增大”“减小”或“不变”)。
(2)同一反应可用多种催化剂,为探究不同催化剂的催化效果,小组同学利用控制变量方法,探究氯化铁溶液和硫酸铜溶液对过氧化氢分解的催化效果,实验中的下列变量中,不需控制的是______________。
A 过氧化氢溶液的浓度和体积
B 催化剂的用量与浓度
C 反应温度,
D 反应开始的时间
【题目】小强帮助老师整理药品时,在药品室发现盛氢氧化钠溶液的试剂瓶瓶口有大量白色固体(如图所示),于是他和小组同学进行了相关探究。

[提出问题]白色固体是什么?
[猜想]猜想一:可能是氢氧化钠。
猜想二:可能是碳酸钠,原因是_________________(用化学方程式表示)。
[资料]氯化钙溶液、氯化钡溶液均显中性。
[方案设计]
设计者 | 操作 | 预期现象与结论 |
张艳 | 取样 ,加水溶解,滴加酚酞溶液,振荡 | 若溶液变红色,则猜想一正确,否则猜想二正确 |
卢斌 | 取样,加水溶解,滴加氯化钙溶液,振荡 | 若产生___________,则猜想二正确,否则猜想一正确 |
[分析]同学们讨论后认为,上述方案都不合理。张艳方案不合理的原因是______________。
[完善与实验]请你将下列实验报告补充完整。
操作 | 现象 | 结论 |
取样,加水溶解,加入足量的___________, 充分反应后,取上层清液,滴加__________ | ___________ | 白色固体是氢氧化钠和碳酸钠的混合物 |
[拓展]如果要除去氢氧化钠溶液中混有的碳酸钠,可采取的措施是__________________。