题目内容
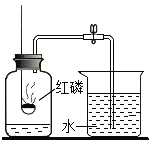
【题目】某兴趣小组的同学在实验室探究金属的部分性质,部分操作如图,请回答相关问题:
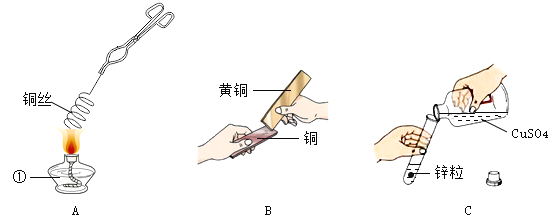
(1)仪器①的名称为__________________。
(2)操作A中铜丝发生反应的化学方程式为__________________,将铜丝绕成螺旋状,可使现象更明显,其原因是__________________。
(3)操作B的目的是__________________。
(4)根据操作C可比较两种金属的活动性强弱,实验中观察到锌粒表面有红色物质覆盖,由此可得出的结论是__________________。
(5)如果向硫酸铜溶液中加入一定量的镁粉和铁粉的混合物,充分反应后过滤,向滤渣中滴加稀盐酸,有气泡产生,则滤液中含有的金属离子是__________________ (写出所有可能情况,填离子符号)。
【答案】酒精灯 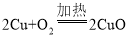 增加了受热面积 比较黄铜和铜的硬度 锌的活动性比铜强 Mg2+或Mg2 +和Fe2+
增加了受热面积 比较黄铜和铜的硬度 锌的活动性比铜强 Mg2+或Mg2 +和Fe2+
【解析】
(1)仪器①的名称为酒精灯;
(2)操作A中铜丝发生反应为铜和氧气在加热条件下生成氧化铜;化学方程式为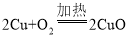 ,将铜丝绕成螺旋状,可使现象更明显,其原因是增加了受热面积、与氧气的接触面积;
,将铜丝绕成螺旋状,可使现象更明显,其原因是增加了受热面积、与氧气的接触面积;
(3)操作B的目的是通过刻划,比较黄铜和铜的硬度,铜被划出痕迹,说明铜的硬度比黄铜的小;
(4) 在金属活动顺序表中,金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。操作C对应实验中观察到锌粒表面有红色物质覆盖,说明锌能和硫酸铜反应,由此可得出的结论是锌的活动性比铜的强;
(5)如果向硫酸铜溶液中加入一定量的镁粉和铁粉的混合物,由于镁的活动性比铁的强,镁先与硫酸铜反应生成硫酸镁和铜,如果硫酸铜有剩余,铁粉继续与硫酸铜反应生成硫酸亚铁和铜。充分反应后过滤,向滤渣中滴加稀盐酸,有气泡产生,说明镁、或镁和铁都有剩余,同时硫酸铜完全反应。则滤液中含有的金属离子是Mg2+或Mg2 +和Fe2+。