【题目】化学小组的同学们在完成“铁粉与水蒸汽反应”的拓展实验时总是效果不好,于是大家想对这个实验的影响因素作进一步研究,开展了以下研究活动。
(查阅资料)实验中可以用Ca(OH)2固体加热来提供稳定的水蒸汽,反应原理如下:
(1)Ca(OH)2 ![]() H2O↑+ CaO
H2O↑+ CaO
(2)3Fe+4H2O(水蒸汽)![]() Fe3O4+ 4H2↑
Fe3O4+ 4H2↑
(猜想假设)此实验的影响因素有Ca(OH)2的质量、铁粉的质量和反应物的放置方式
(进行实验)同学们组装了如图所示的实验装置(酒精灯外焰约600℃)。
用洗涤灵配制发泡剂,将玻璃导管伸入发泡剂中观察氢气的产生;选定 “氢气泡爆鸣时间”为实验效果指标。“氢气泡爆鸣时间”指的是从开始加热到第一个氢气泡燃着并发出爆鸣声的时间。
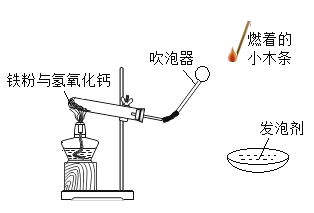
为了排除偶然因素的干扰,共进行了4次平行实验。“氢气泡爆鸣时间”的数据是平行实验数据的平均值。实验数据整理在下表
因素 序号 | 反应物放置方式 | 铁粉的质量/g | Ca(OH)2的质量/g | 实验指标 |
氢气泡爆鸣时间/s | ||||
1 | 铁粉在上层 | 0.5 | 1.5 | 151 |
2 | 铁粉在下层 | 0.5 | 0.5 | 88 |
3 | 混合 | 0.5 | 1.0 | 77 |
4 | 铁粉在上层 | 1.0 | 1.0 | 119 |
5 | 铁粉在下层 | 1.0 | 1.5 | 44 |
6 | 混合 | 1.0 | ? | 58 |
7 | 铁粉在上层 | 1.5 | 0.5 | 66 |
8 | 铁粉在下层 | 1.5 | 1.0 | 54 |
9 | 混合 | 1.5 | 1.5 | 60 |
(解释与结论)
(1)实验中用“点燃观察气泡燃着并发出爆鸣声证明氢气产生”是利用了氢气的_____(填写物质的性质)
(2)实验6中Ca(OH)2的质量应为____g。
(3)通过对以上实验数据分析,发现了最佳实验条件,并采用最佳实验条件又做了验证性实验如下表 ,将下表补全。
反应物放置方式 | 铁粉的质量/g | Ca(OH)2的质量/g | 氢气泡爆鸣时间/s |
________ | _________ | 0.5 | 35 |
(4)将表1中部分数据转化为曲线图,如图,比较“铁粉的质量”,“Ca(OH)2的质量”两个因素对实验效果影响较大的因素是________________。
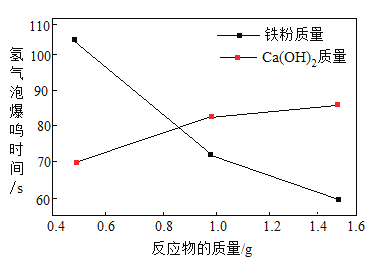
(5)通过观察数据发现“铁放置在下面”比“铁粉放置在上面”、“和氢氧化钙混合”实验效果都好,从反应的条件角度试分析其原因_________。
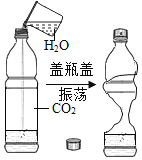
【题目】小云同学完成如图实验:向盛满CO2气体的塑料瓶中加入澄清的石灰水,拧紧瓶盖振荡。让她吃惊的是瓶子虽然变瘪了,但是并没有看到白色沉淀。

(发现问题)沉淀哪去了?
(探究环节一)
提出猜想:二氧化碳没有和氢氧化钙反应,而是直接溶于水了。于是设计如下实验进行验证。
步骤 | 操作 | 实验现象 |
1 | (1)取2个相同规格的软塑料瓶, 分别集满二氧化碳气体 (2)分别向 2 个塑料瓶中注入等体积的氢氧化钙溶液和蒸馏水, 拧紧瓶盖,振荡 | 2 个塑料瓶都变瘪了,但是注入氢氧化钙溶液的塑料瓶瘪的程度更大 |
2 | (1)用pH试纸测反应前氢氧化钙溶液的酸碱度 (2)向软塑料瓶中注入适量氢氧化钙溶液震荡后,测反应后溶液的 pH 值 | 反应前氢 氧 化 钙 溶 液 的 pH 大于 7; 反应后 溶液的pH小于7 |
(1)小云预期会看到白色沉淀的依据是______________________(写出反应的化学方程式)
(2)反应后溶液的pH小于7是由于生成了____(写化学式);通过分析以上实验现象,小云得到的结论是_______________________。
(探究环节二)
查阅资料后得知:适量的二氧化碳和氢氧化钙能发生反应生成难溶于水的碳酸钙,如果二氧化碳过量,则碳酸钙会继续和二氧化碳反应生成可溶性的碳酸氢钙。(“→”代表反应的方向)CO2+CaCO3+H2O ![]() Ca(HCO3)2
Ca(HCO3)2
提出猜想:实验中可能二氧化碳过量,反应生成了碳酸氢钙,所以没有看到沉淀
步骤 | 操作 | 实验现象 |
1 | 取少量的氢氧化钙溶液于试管中,向其中持续通入CO2气体 | 开始产生白色沉淀过一会儿,白色沉淀消失 |
2 | (1)取一个软塑料瓶,集满二氧化碳气体,向其中注入少量的氢氧化钙溶液,拧紧瓶盖,振荡 (2)此时将软塑料瓶放在热水浴中加热 (3)将加热后的软塑料瓶冷却 | 瓶子变瘪 溶液变浑浊 溶液又变澄清 |
3 | (1)取一个软塑料瓶,集满二氧化碳气体,向其中注入少量的氢氧化钙溶液,拧紧瓶盖,振荡 (2)向实验后的软塑料瓶中继续滴加氢氧化钙溶液 | ? |
实验结论:猜想成立
(1)实验步骤2中“改变瓶子的温度”目的是___________。
(2)实验步骤3中看到的实验现象是________________。
【题目】利用表中装置进行下列实验。已知:白磷的着火点为40℃。
实验装置 | 实验步骤 |
| Ⅰ.集气瓶的容积为250mL,实验开始前在集气瓶内加入50mL蒸馏水;在燃烧匙内加入足量白磷,塞紧瓶塞;取下注射器,吸入足量的、红颜色的水,再连接好装置。 Ⅱ.将组装好的实验装置转移到80℃热水中浸泡,片刻后白磷燃烧。 Ⅲ.待白磷熄灭后,再将整套装置放入冷水中冷却至室温。 |
(1)组装仪器后,用手向上拉动注射器活塞。松开手后,观察到________________,说明此装置气密性良好。
(2)冷却后进入集气瓶的红颜色的水的体积是_____mL。
(3)若在以上实验过程中,同时完成“验证可燃物燃烧需要满足温度达到着火点的条件”,还需补充的实验操作及现象是_______________________。
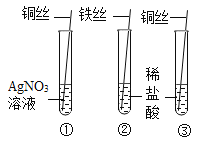
【题目】下列实验方案能达到实验目的是
选项 | A | B | C | D |
实验 目的 | 证明CO2可与H2O反应生成H2CO3 | 除去O2中混有的CO2 | 证明某混合溶液中含有碳酸盐 | 验证铁、铜、银三种金属的活动性顺序 |
实验方案 |
|
|
|
|
A.AB.BC.CD.D
【题目】阅读下面科普短文。
生活中我们谈到“细菌”往往会心惊胆战。其实细菌不仅仅只有危险的一面,如果掌握了它们的特性,很多细菌也可以为我们服务。氧化亚铁硫杆菌(以下简称为T·f菌,见图左)是一种细菌,它被广泛应用于治理废气、废渣等有害物质。例如用T· f菌脱除工业废气中的一种有毒、有腐蚀性的气体——硫化氢(H2S)。其作用原理如图所示。


这个净化过程中,Fe2(SO4)3溶液在常温常压下就可以将废气中的H2S脱出,生成FeSO4 。FeSO4在酸性溶液中、在T· f菌的帮助之下,只需少量的氧气就又可以转化为Fe2(SO4)3 ,同时释放的能量还能供给T· f菌生长。用这种方法处理废气大大降低了治污的成本,脱除率达到99.97%,且无废物排出。但要达到高效的关键是要保证体系内FeSO4 浓度的稳定,一旦FeSO4 浓度降低,T· f菌就会像缺少食物一样逐渐失去活性。实际应用过程发现Fe2(SO4)3在pH=l.9时会发生一定的变化,生成了铁的沉淀物——黄铵铁矾〔NH4Fe3(SO4)2(OH)6〕,并在pH=3.2时沉淀完全,使得溶液中的总铁浓度下降。可见溶液的pH值对这个方法的效果有一定影响。实验测得30℃时,不同pH环境下T· f菌的活性不同,表现为FeSO4溶液转化为Fe2(SO4)3溶液的速率不同,如下表:
pH | 0.9 | 1.2 | 1.5 | 1.9 | 2.1 | 2.4 | 2.7 | 3.0 |
FeSO4溶液转化为Fe2(SO4)3速率/(gL﹣1h﹣1) | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 | 6.2 | 5.6 |
回答下列问题:
(1)在环节①中化合价升高的元素是_____(填写元素符号)。
(2)环节②的反应原理为:4 F e S O4+ O2+ 2X![]() 2F e2(S O4)3+2H2O其中物质“X”的化学式为_____。
2F e2(S O4)3+2H2O其中物质“X”的化学式为_____。
(3)黄铵铁矾〔NH4Fe3(SO4)2(OH)6〕中铁元素与硫元素的原子个数比为__________。
(4)用T·f菌脱除废气中的H2S气体的优点是_______(写出1点即可)
(5)请结合文中信息,判断工业用T·f菌脱硫应选择的最佳pH范围是_____<pH<__。