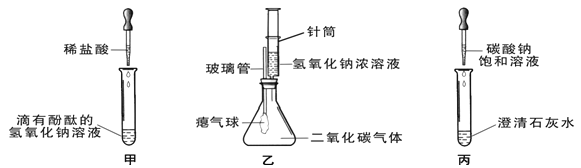
【题目】从海水得到的粗盐往往含有可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等),必须进行分离和提纯后才能用于工业生产和人们的日常生活.实验室模拟工业粗盐提纯的流程如图,请回答: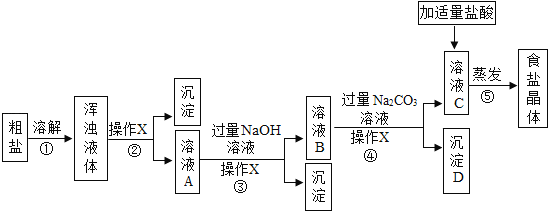
(1)步骤①和②的目的是________,步骤③的主要目的是________.
(2)操作X的名称是________,该操作中用到的玻璃仪器有烧杯、玻璃棒和________.向溶液C中加入适量盐酸,控制盐酸用量的操作方法是________.
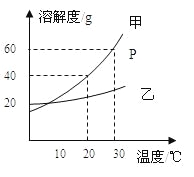
(3)本实验从滤液C得到精盐,采用的是蒸发溶剂的方法而不用降低溶液温度的方法,参考溶解度数据分析原因________.
(4)下表提供了两种物质的溶解度数据,读取信息后回答:
温度℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
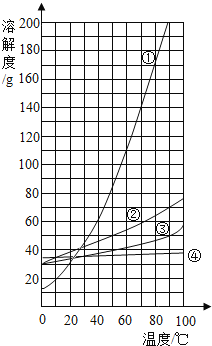
看图判断,氯化钠的溶解度曲线是上图________(填数字编号),40℃时,将60g硝酸钾溶于100g水中,降温至10℃时可析出硝酸钾晶体________ g.
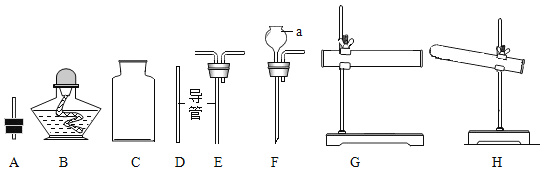
【题目】某校化学兴趣小组利用下列仪器在实验室进行制取O2的相关实验探究,请回答下列问题.
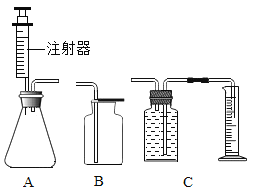
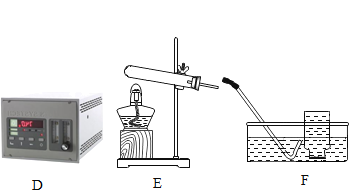
(1)甲小组用MnO2、KClO3两种药品制取干燥的O2,需选用的仪器组合是________,反应结束后回收MnO2固体,操作依次是冷却至室温、________、过滤、________、烘干.
(2)乙小组探究Fe2O3能否作为H2O2分解的催化剂.实验时间为30s(H2O2过量),其他可能影响实验的因素均保持不变,相关数据如下:
实验序号 | 10%的H2O2溶液(mL) | 溶液中加入物质(g) | 收集到气体的 体积(mL) |
1 | 100 | 无 | a |
2 | 100 | Fe2O30.5g | b |
3 | 100 | MnO20.5g | c |
通过比较和______(填“a”“b”“c”)的大小,可证明Fe2O3在实验中起催化作用,写出该反应的化学方程式________.其次需补做实验,验证反应前后Fe2O3的化学性质不变和验证________.
(3)丙小组探究MnO2的用量对H2O2分解速率的影响.每次均用30mL10%的H2O2溶液,使用不同质量的MnO2作催化剂,测定每次收集到500mL O2所用的时间.结果如图(其他实验条件相同):
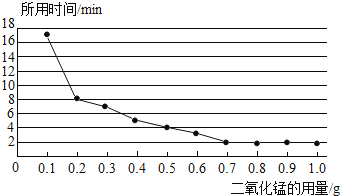
由图可知,MnO2的用量对H2O2分解速率影响的规律是①________; ②MnO2的用量超出一定范围后,其用量再增大,反应速率不再继续加快.