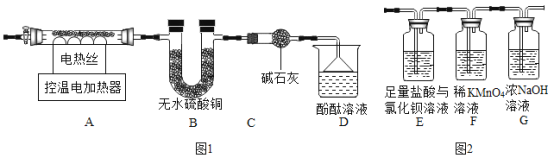
【题目】化学小组同学发现在面包制作过程中加入了一些白色粉末,使面包变得松软。同学们对白色粉末的成分进行探究。
(查阅资料)①经调查,市场上有以下3种主要产品。
商品名称 | 小苏打 | 食臭粉 | 混合碱性膨松剂 |
主要成分 | 碳酸氢钠 | 碳酸氢铵 | 碳酸氢钠和碳酸氢铵 |
②2NaHCO3![]() Na2CO3+H2O+CO2↑;NH4HCO3
Na2CO3+H2O+CO2↑;NH4HCO3![]() NH3↑+H2O+CO2↑;2NH3+H2SO4=(NH4)2SO4
NH3↑+H2O+CO2↑;2NH3+H2SO4=(NH4)2SO4
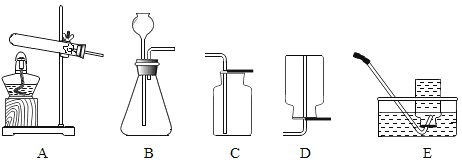
(实验准备)同学们选用下列实验装置,经组合进行实验:
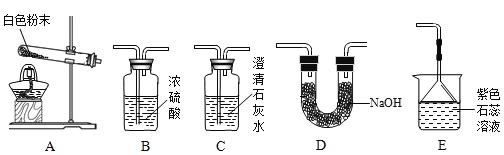
(实验记录)
实验序号 | 实验装置 | 实验现象 | 实验结论及分析 |
实验1 | 选用A、B、C | C中澄清石灰水变浑浊 | 有CO2生成,C中反应的化学方程式是_____ |
实验2 | 选用A、_____和E | E中紫色石蕊溶液变_____色 | 有NH3生成 |
(实验分析)
根据上述实验,甲同学认为该粉末的主要成分为食臭粉,乙同学认为上述实验不能确定该粉末为食臭粉。为进一步确认其组成及含量,同学们设计了如下定量实验:
实验序号 | 实验目的 | 实验装置 | 数据记录 | 实验结论 |
实验3 | 测定生成CO2的质量 | 选用A、B、D | 装置D增重ag | 该粉末为“混合碱性膨松剂” |
实验4 | 测定生成NH3的质量 | 选用A、D、B | 装置B增重1.7g |
(1)实验3中装置B的作用是_____。
(2)实验3中测得装置D增重ag,则a>_____g。
(3)若测得a为92.4,该碱性膨松剂中NaHCO3与NH4HCO3的质量比为_____