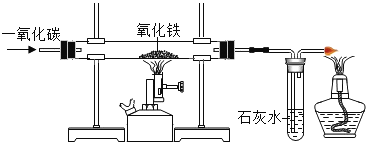
【题目】实验室模拟工业炼铁的装置图如图所示。

(1)写出一氧化碳与氧化铁反应的化学方程式__________________。
(2)写出硬质玻璃管中的现象__________________。
(3)写出最右侧酒精灯的作用__________________。
【答案】Fe2O3+3CO![]() 2Fe+3CO2 红色粉末逐渐变黑 点燃尾气,防止CO污染空气
2Fe+3CO2 红色粉末逐渐变黑 点燃尾气,防止CO污染空气
【解析】
(1)由题意可知,在高温条件下,一氧化碳能与氧化铁反应,生成了铁和二氧化碳。反应的方程式是:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(2)由于氧化铁是红色的,生成的铁粉是黑色的。所以,硬质玻璃管中的现象是:红色粉末逐渐变黑;
(3)由于尾气中含有的一氧化碳有毒能污染空气。所以,最右侧酒精灯的作用是:点燃尾气,防止CO污染空气。
故答案为:Fe2O3+3CO![]() 2Fe+3CO2;红色粉末逐渐变黑;点燃尾气,防止CO污染空气。
2Fe+3CO2;红色粉末逐渐变黑;点燃尾气,防止CO污染空气。
【题型】实验题
【结束】
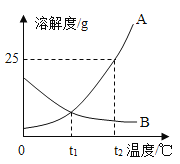
25
【题目】酸、碱、盐是几类重要的化合物,他们之间能发生复分解反应。
(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有____________生成。
(2)某化学小组进行“酸和碱的中和反应”实验:将盐酸滴入一定量的澄清石灰水中,实验无明显现象。取反应后的部分溶液加热、蒸干、得到白色固体。
以下是探究白色固体成分的实验,已知CaCl2溶液呈中性。请填写下表:
实验操作 | 测定结果 | 白色固体成分 |
用pH试纸测定反应后溶液的酸碱度,操作方法是_______ | pH>7 | __________ |
_______ | CaCl2 |
实验反思:无明显现象的中和反应可借助酸碱指示剂判断反应终点。
(3)“粗盐提纯”指除去NaCl中的泥沙和MgCl2、CaCl2、Na2SO4等杂质。某同学设计了除去三种可溶性杂质的实验方案:先将固体溶解,然后向其中依次加入过量的BaCl2、NaOH、Na2CO3溶液,充分反应后过滤,蒸发结晶。请回答:
①溶解、过滤和蒸发操作中都用到一种玻璃仪器是_______?该仪器在蒸发操作中的作用是_______?
②加入Na2CO3溶液的目的是______________?
③以上方案还需完善,请说明原因并加以补充_______。
(4)工业上常用NaOH溶液处理铝土矿(主要成分为Al2O3),反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O(杂质不参与反应也不溶于水)。若用160 kg NaOH配制的溶液恰好能处理340 kg铝土矿,最终得到1 004 kg NaAlO2溶液。计算:该铝土矿中Al2O3的质量分数_______。
【题目】甲、乙、丙三种物质的转化关系如右图所示(“→”表示反应一步实现,部分物质和反应条件已略去)。下列选项不能实现图示转化的是
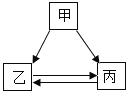
选项 | 甲 | 乙 | 丙 |
A | H2SO4 | H2 | H2O |
B | C | CO | CO2 |
C | Ca(OH)2 | CaCl2 | CaCO3 |
D | NaOH | NaCl | NaNO3 |
A. A B. B C. C D. D
【题目】(1)小明在帮老师整理实验室时,发现一瓶未密封的NaOH固体,对其成分提出以下假设,并在老师的指导下进行实验探究
(查阅资料):①NaOH暴露在空气中易变质请用化学方程式解释NaOH变质的原因_____
②Na2CO3溶液呈碱性,BaCl2溶液NaCl溶液呈中性
(猜想假设):假设I:只含NaOH;假设Ⅱ:含NaOH和Na2CO3;假设Ⅲ:只含Na2CO3
(进行实验):
实验操作步骤 | 实验现象 | 实验结论 |
①取少量样品于试管中,加入足量的稀盐酸 | 有气泡产生 | 假设_____不正确 |
②另取少量样品于试管中,加水溶解,加入 过量的BaCl2溶液,振荡,静置 | _____ | 假设Ⅲ正确 |
③取②中上层清液,滴加无色酚酞溶液 | _____ |
(问题讨论):步骤②中加入过量BaCl2溶液的作用是_____,如将②中BaCl2溶液换成Ba(OH)2溶液,实验能否成功?_____(填“能”或“不能”),原因是_____
(2)小红为了测定一瓶未密封保存已部分变质的NaOH固体中NaOH的质量分数,采用沉淀法进行如下操作:①取15克样品于烧杯中,加足量水配成溶液;
②在样品溶液中加入足量的BaCl2溶液;
③待反应完全后,过滤有关数据记录如下表:
反应前 | 反应后 | |
烧杯和样品溶液总质量/g | 加入氯化钡溶液质量/g | 过滤后烧杯和溶液总质量/g(滤液的损失忽略不计) |
95 | 65 | 140.3 |
请回答下列问题:
①在反应前后的溶液中,下列元素质量保持不变的是_____
A钠元素 B碳元素 C钡元素 D氧元素
②原样品中NaOH的质量分数是多少?(写出计算过程)_____