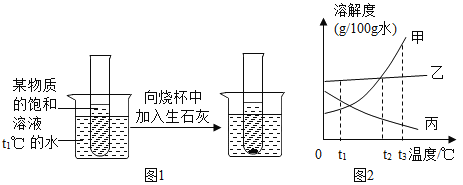
【题目】氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如下:
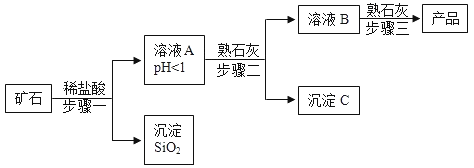
(1)请写出步骤一中发生反应的化学方程式:________(任写一个)。
(2)溶液A中所含的阳离子有________(填离子符号)。
(3)已知:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀 | 1.9 | 4.2 | 9.1 |
完全沉淀 | 3.2 | 6.7 | 11.1 |
步骤二中加入熟石灰,调节溶液的pH范围为________。
(4)3个步骤中均用到的操作是________。
(5)步骤三中生成产品的化学方程式为________。
某同学用酒精灯加热盛有固体药品的试管,实验结束后,发现试管破裂,试分析造成试管破裂可能是由哪几种错误操作引起的。(至少答出两条)①__________________________②______________________
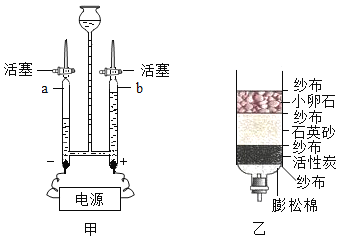
【题目】在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体。某兴趣小组请你参与研究:铁与水蒸气反应一段时间后剩余固体物质的成分、性质及再利用。
实验装置如图所示(夹持仪器略)
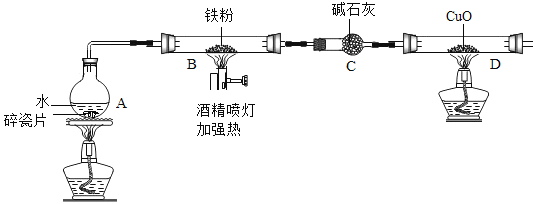
(1)(推断)观察到D中黑色固体变红,则B中生成的气体是_____________。
(2)探究B装置中剩余固体成分是什么?
(查阅资料)
(1).碎瓷片能防爆沸;碱石灰是氧化钙和氢氧化钠的混合物
(2).铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引。
(初步探究)
B装置中剩余固体为黑色,能全部被磁铁吸引。
(猜想与假设)
猜想一:剩余固体是Fe3O4;
猜想二:剩余固体是_____________。
(实验探究)
实验操作 | 实验现象及结论 |
取少量黑色固体于试管中,加入足量的稀盐酸(或稀硫酸) | 若固体全部溶解,没有气泡冒出,剩余固体是Fe3O4,若固体全部溶解,有气泡冒出,剩余固体是Fe和Fe3O4(与实验操作一致) |
(实验结论)铁与水蒸气反应的化学方程式为_____________。
(3)(成分再利用)若将B装置中剩余的黑色固体a g,经过一系列转化,全部变为红棕色固体Fe2O3(假设转化过程中铁元素无损耗),增加的质量为x,则x的取值范围为_____________。