题目内容
【题目】水在生活、生产中和化学实验中起着十分重要的作用。
Ⅰ.自来水厂净化水的过程为:取水→沉降→过滤→吸附→消毒,高铁酸钾(K2FeO4)能用作絮凝剂。
(1)制备K2FeO4的化学方程式为2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6X+8H2O,则X的化学式为 ________,K2FeO4中铁元素的化合价为________。
(2)自来水厂的净水过程________(选填“能”或“不能”)将硬水软化成软水。
Ⅱ.欲证明一瓶无色透明液体是纯水,可靠的实验方法是(____)
A 1.01×105 Pa时沸点为100 ℃
B 测得其pH=7
C 电解时得到H2与O2的体积比为2∶1
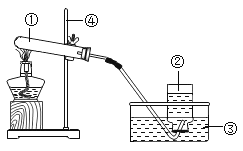
Ⅲ.请根据如图实验现象并结合溶解度曲线回答(其中甲、乙、丙均不含结晶水)。
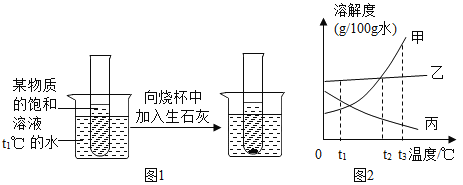
(1)生石灰与水反应的化学方程式为________,试管内所盛饱和溶液的溶质为对应溶解度曲线中的________(选填“甲”“乙”或“丙”)。
(2)如果要配制相同浓度的甲、乙饱和溶液,需要把温度控制在________℃。
(3)t3℃时,将甲、乙、丙的饱和溶液都降温到t1℃,溶液中溶质质量分数由小到大的顺序为________。
【答案】KCl +6 不能 A CaO+H2O═Ca(OH)2 丙 t2 丙<甲<乙
【解析】
(1)由2Fe(OH)3+3Cl2+10KOH═2K2FeO4+6X+8H2O,根据质量守恒定律,化学反应前后原子的种类和数目不变,反应前Fe、O、H、Cl、K的原子个数分别是2、16、16、6、10;反应前Fe、O、H、Cl、K的原子个数分别是2、16、16、0、0,则6X中有6个K和6个Cl,则X的化学式为KCl;
因为钾元素显+1价,氧元素显-2价,则设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×4=0,则x=+6价.
(2)自来水厂净化水的过程不能将硬水软化成软水.
(3)
A、纯水在常压下的沸点为1000C,可通过测定沸点的方法证明是否为纯水,故正确;
B、强酸强碱盐的水溶液pH=7,不能确定是否为纯水,故错误;
C.电解活泼金属的含氧酸盐时,得到H2、O2,体积比为2:1,不能确定是否含有纯水,故错误;
(4)①生石灰与水反应生成氢氧化钙,反应的化学方程式为CaO+H2O═Ca(OH)2;石灰与水反应放热,溶液温度升高,有晶体析出,说明物质的溶解度随温度的升高而降低,故选丙;
②由于在t2℃时,甲、乙的溶解度相同,则如果要配制相同浓度的甲、乙饱和溶液,需要把温度控制在t2℃.
③由甲、乙、丙三种固体物质的溶解度曲线可知,甲、乙的溶解度随温度的升高而增大,丙的溶解度随温度的升高而减小,所以将t3℃甲、乙、丙的饱和溶液分别降温到t1℃,甲、乙析出晶体,溶质的质量分数减小,丙变为不饱和溶液,溶质质量分数与降温前相等,据饱和溶液中质量分数的计算式![]() ×100%可知,t1℃时乙的溶解度大于甲的溶解度、大于t3℃时丙的溶解度,t1℃时甲的溶解度大于t3℃时丙的溶解度,所以此时所得溶液中溶质的质量分数由小到大的顺序是:丙<甲<乙.
×100%可知,t1℃时乙的溶解度大于甲的溶解度、大于t3℃时丙的溶解度,t1℃时甲的溶解度大于t3℃时丙的溶解度,所以此时所得溶液中溶质的质量分数由小到大的顺序是:丙<甲<乙.
答案:
(1)KCl;+6;
(2)不能;
(3)A;
(4)①CaO+H2O═Ca(OH)2;丙;②t2;③丙<甲<乙.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案